题目内容
(每空2分,共10分)
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH溶液,其
正极反应为________________________ _ ___,
负极反应为__________________________________________;
(2)若电解质溶液为H2SO4,其正极反应为________________,负极反应为________ ____;若反应过程中转移了2mol电子,可产生水的质量为_____ ____g。
【答案】
(每空2分,共10分)(1)O2+2H2O+4e-=4OH-,2H2-4e+4OH-=4H2O;
(2)O2+4H++4e-=2H2O,2H2-4e-=4H+ ;18 g。
【解析】原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入。
(1)若电解质溶液为KOH溶液,则正极反应为O2+2H2O+4e-=4OH-;负极反应为2H2-4e+4OH-=4H2O。
(2)若电解质溶液为H2SO4,则正极反应为O2+4H++4e-=2H2O;负极反应为2H2-4e-=4H+ ;反应过程中转移了2mol电子,则必然生成1mol水,其质量是18g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(每空2分,共10分)食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(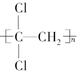 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。
| A.分子式为C18H34O2 |
| B.一定条件下能与乙酸发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是__________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:_________________________________。
 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。