��Ŀ����
����Ŀ��ij��ѧ��ȤС����ʵ�����ó�ȥ���������������(̼�ظ�)��Ũ���Ṳ����ȡSO2 ������������̽��(������ˮ����)��
(1)��ͬѧ��Ϊ�Ƶõ�SO2 �п��ܻ������ʣ��仯ѧʽΪ______��_________��ԭ����________��
(2)Ϊ��֤����ɷ֣���ȤС��ͬѧ�������ͼ��ʾװ�ý�����ʵ��̽����
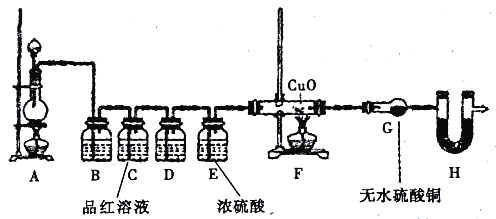
��Ϊ��֤������SO2��װ��B �м�����Լ�Ϊ_____װ��C��Ʒ����Һ��������_______��
��װ��D�м�����Լ�Ϊ____________��
��װ��G�п��ܳ��ֵ�����Ϊ____________��
��װ��H������Ϊ____________��
(3)��ȤС�������ͼװ����֤��������Ļ�ѧ���ʡ�
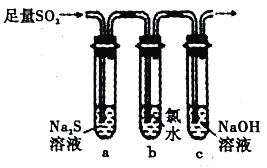
������֤SO2 ���������Ե�ʵ������Ϊ____________��
��Ϊ��֤SO2 �Ļ�ԭ�ԣ�ȡ�Թ�b �г�ַ�Ӧ�����Һ�ֳ����ݣ��ֱ��������ʵ��:
����I:���һ����Һ����Ʒ����Һ����ɫ��ȥ
������:��ڶ�����Һ����BaCl2��Һ��������ɫ����
������:���������Һ�м���AgNO3 ��Һ���а�ɫ��������
���������к�������____________���I���� �����Թ�b �з�����Ӧ�����ӷ���ʽΪ____________��
���𰸡� CO2 H2 �����к�C�ڼ��������»��Ũ���ᷴӦ����CO2�����ŷ�Ӧ���У�Ũ�����ϡ������ϡ���ᷴӦ�������� ����KMnO4��Һ(����������Ҳ����) ��֤SO2�Ƿ�������ȫ ����ʯ��ˮ ��ˮ����ͭ����ɫ ��ֹ������H2O�������ܶ�Ӱ����������ļ��� a�Թ����е���ɫ�������� �� Cl2+SO2+2H2O=4H++2Cl-+SO42-
����������1�������к�C�ڼ��������»��Ũ���ᷴӦ����CO2�����ŷ�Ӧ���У�Ũ�����ϡ������ϡ���ᷴӦ�������������Ƶõ�SO2�п��ܻ�������ΪCO2��H2����2����װ��B�м�������KMnO4��Һ�ܼ��鲢����SO2����SO2��������ȫ��װ��C��Ʒ����Һ����ɫ����װ��D�м������ʯ��ˮ���ɼ����������Ƿ���CO2����װ��E��Ũ����ɸ������壬װ��F��CuO��H2��Ӧ����H2O��G����ˮ����ͭ����ˮ���������ɫ����װ��H���и������������Ϊ��ֹ������H2O�������ܶ�Ӱ����������ļ��飻��3����Na2S��SO2����������ԭ��Ӧ����S����a�Թ����е���ɫ�������ɣ��ڢ������SO2����������SO42-,��Ba2+��Ӧ���ɰ�ɫ�������ݴ���֤��SO2�Ļ�ԭ�ԣ��Թ�b�з�����Ӧ�����ӷ���ʽΪ��Cl2+SO2+2H2O=4H++2Cl-+SO42-��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij�ػ�������ȡһ����ij�����������Է�ˮ�����ֳɼס��ҡ��������ķݣ�������ͼ��ʾ̽����

��֪����ˮ�����г�H+����ܺ����±��е����ӣ�
������ | Na����Mg2����X |
������ | Cl����SO |
��ش��������⣺
��1������X��________________(�ѧʽ����ͬ)������Y��________________��
��2�����в���ȷ���Ƿ���ڵ���������________����֤�����������Ƿ���ڵļ�ʵ�����Ϊ____________________________________________________________________________��
��3��д����ˮ�����еμӵ���KI��Һ��������Ӧ�����ӷ���ʽ: _____________________��

