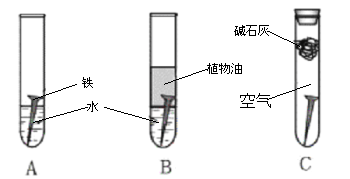
题目内容
【题目】下列说法中正确的是
A.二氧化碳的水溶液能导电,二氧化碳是电解质
B.![]() 的硫酸钠溶液和
的硫酸钠溶液和![]() 的氢氧化钠溶液导电性不同
的氢氧化钠溶液导电性不同
C.氢氧化铁胶体能导电,故氢氧化铁胶体是电解质
D.在相同温度下,饱和溶液一定比不饱和溶液的导电性强
【答案】B
【解析】
A.二氧化碳的水溶液能导电,是因为生成碳酸溶液导电,但二氧化碳自身不能电离出阴阳离子,故不是电解质,故A错误;
B.![]() 的硫酸钠溶液和
的硫酸钠溶液和![]() 的氢氧化钠溶液中单位体积内自由移动的离子数目不等,溶液导电性不同,故B正确;
的氢氧化钠溶液中单位体积内自由移动的离子数目不等,溶液导电性不同,故B正确;
C.氢氧化铁胶体能导电,是因为胶体粒子带电,且氢氧化铁胶体是混合物,不属于电解质也不属于非电解质,故C错误;
D.导电能力取决于溶液中离子浓度大小,电解质不同,饱和溶液中的离子浓度不一定比不饱和溶液中的离子浓度大,所以导电性大小无法比较,故D错误;
故答案选B。

【题目】利用如图所示装置测定中和热的实验步骤如下:
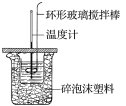
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(填字母,下同)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______(填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______________________。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=_______________(结果保留一位小数)。