题目内容
【题目】下列正确的是( )
A.碳酸的电离:H2CO3?H++HCO ![]()
B.硫化钠水解:S2﹣+2H2O?H2S↑+2OH﹣
C.Na2CO3溶液中:c(HCO ![]() )>c(OH﹣)
)>c(OH﹣)
D.NH4Cl溶液中,c(NH ![]() )>c(Cl﹣)
)>c(Cl﹣)
【答案】A
【解析】解:A.碳酸为二元弱酸,分步电离,电离方程式为:H2CO3H++HCO ![]() ,HCO
,HCO ![]() H++CO
H++CO ![]() ,以第一步为主,故A正确; B.硫离子是多元弱酸阴离子分步水解,水解程度微弱,不能生成硫化氢气体,水解的离子方程式为:S2﹣+H2OHS﹣+OH﹣ , HS﹣+H2OH2S+OH﹣ , 故B错误;
,以第一步为主,故A正确; B.硫离子是多元弱酸阴离子分步水解,水解程度微弱,不能生成硫化氢气体,水解的离子方程式为:S2﹣+H2OHS﹣+OH﹣ , HS﹣+H2OH2S+OH﹣ , 故B错误;
C.由于盐类的水解程度很小,故离子浓度大小关系为:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO ![]() )>c(H+),故C错误;
)>c(H+),故C错误;
D.氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2ONH3 . H2O+H+ , 所以c(H+)>c(OH﹣),铵根离子水解、钠离子不水解,所以c(Cl﹣)>c(NH4+),故D错误;
故选A.

【题目】现有含FeCl2杂质的氯化铜晶体(CuCl22H2O),为制取纯净的CuCl22H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯: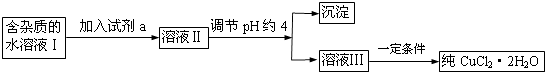
25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 4.7 |
完成沉淀pH | 3.2 | 9.7 | 6.7 |
请回答下列问题:
(1)流程中加入的试剂a最合适的是(填序号)A.酸性高锰酸钾溶液 B.NaClO溶液C.H2O2溶液 D.稀硝酸
加入试剂a的目的是 .
(2)调节pH约4应该加入的物质可以是 .
A.CuO
B.CuCl2
C.Cu(OH)2
D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl22H2O?(填“能”或“不能”).
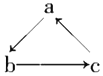
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. A B. B C. C D. D