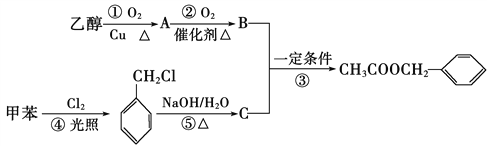
��Ŀ����
����Ŀ�����к�FeCl2���ʵ��Ȼ�ͭ���壨CuCl22H2O����Ϊ��ȡ������CuCl22H2O�����Ƚ����Ƴ�ˮ��Һ��Ȼ����ͼ��ʾ��������ᴿ��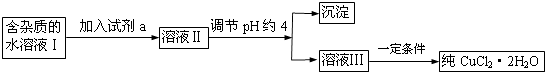
25�沿��������������������ʽ��ȫ����ʱ��Һ��pH���±���
������ | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 |
��ʼ����pH | 2.7 | 7.6 | 4.7 |
��ɳ���pH | 3.2 | 9.7 | 6.7 |
��ش��������⣺
��1�������м�����Լ�a����ʵ���������ţ�A�����Ը��������Һ B��NaClO��ҺC��H2O2��Һ D��ϡ����
�����Լ�a��Ŀ���� ��
��2������pHԼ4Ӧ�ü�������ʿ����� ��
A.CuO
B.CuCl2
C.Cu��OH��2
D.NaOH
��3������ܲ���ֱ�������ᾧ�õ�CuCl22H2O������ܡ����ܡ�����
���𰸡�
��1��C����Fe2+����
��2��AC
��3������
���������⣺��ȡ������CuCl22H2O�������̿�֪������aΪ�������������������ӣ����������������ʣ���aΪH2O2��Һ������pH��3.2��pH��4.4ʹ������ת��Ϊ������Ȼ����ˣ���Һ��HCl�����������ᾧ�õ�CuCl22H2O����1�������м�����Լ�a����ʵ���C����Ŀ���ǽ�Fe2+���������Դ��ǣ�C����Fe2+��������2������ͭ��������ͭ���ɴٽ�������ˮ��ת��Ϊ�������Ȼ�ͭ���ܣ���NaOH����߾���Ӧ���ܳ��ӣ����Դ��ǣ�AC����3������ȴٽ�ͭ����ˮ�⣬���ɵ�HCl�ӷ�������ֱ�������ᾧ�õ�CuCl22H2O�����Դ��ǣ����ܣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���������ᣬ��һ���¶��´ﵽ����ƽ��ʱ��������Ũ�ȴ���һ�ֶ����Ĺ�ϵ���±�Ϊ����������25��ʱ�ĵ���ƽ�ⳣ��
�� | ����ƽ�ⳣ��K |
CH3COOH | 1.76��10��5 |
H2CO3 | K1=4.3��10��7 K2=5.61��10��11 |
H3PO4 | K1=7.52��10��3 K2=6.23��10��8 K3=2.20��10��13 |
�ش��������⣺
��1���ӵ���ĽǶȣ�HCO ![]() ��HPO
��HPO ![]() ��H2PO4�����ɿ������ᣬ����������ǿ���� �� �������� ��
��H2PO4�����ɿ������ᣬ����������ǿ���� �� �������� ��
��2������ƽ�ⳣ������ʵ��ķ����ⶨ�����ģ����Ѿ����25��ʱ��c mol/L��CH3COOH�ĵ���ת����Ϊa������¶��´���ĵ���ƽ�ⳣ��KCH3COOH= ��
����Ŀ��Ϊ��ǿ������ʴ�ԣ�����Ǧ����Ϊ���Դ����Al��������Pb�����������ϡ���ᣬʹ�����������Ĥ�����䷴Ӧԭ�����£���أ�Pb��s��+PbO2��s��+2H2SO4��aq��=2PbSO4��s��+2H2O��l�������أ�2Al+3H2O ![]() Al2O3+3H2�����������У������ж���ȷ���ǣ� ��
Al2O3+3H2�����������У������ж���ȷ���ǣ� ��
��� | ���� | |
A | H+����Pb�缫 | H+����Pb�缫 |
B | ÿ����3molPb | ����2molAl2O3 |
C | ������PbO2+4H++2e��=Pb2++2H2O | ������2Al+3H2O��6e��=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D