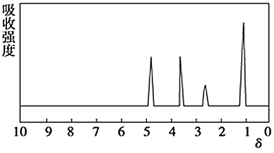
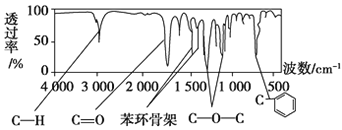
题目内容
【题目】下列是各元素均为1-18号元素,按要求填空:
(1)A元素的原子次外层电子数与最外层电子数之差等于电子层数,则A元素可能是:_____(填元素符号)
(2)B的二价阴离子的核外电子排布与![]() 的核外电子排布相同,则B离子的电子式为_____。
的核外电子排布相同,则B离子的电子式为_____。
(3)在1-18号元素中,选一种金属元素和一种非金属元素,要求这两种元素原子的最外层电子数相同。写出它们的原子结构示意图:____________________;____________________。
(4)在1~18号元素中,任选两种元素,写出它们各自形成的简单离子的电子式,要求所写的两种离子在电荷种类、电荷数量及最外层电子数这三个方向均不相同。_______________;_______。
【答案】C、P ![]()
![]()
![]()
![]() (其它合理答案也可)
(其它合理答案也可) ![]() (其它合理答案也可)
(其它合理答案也可)
【解析】
(1)短周期根据2、3层计算;
(2)B的二价阴离子的核外电子排布与Ar的核外电子排布相同,则B有16个质子;
(3)两种元素原子的最外层电子数相同,两元素为一种金属元素和一种非金属元素,根据周期表判断;
(4)简单离子为单原子离子,电荷种类不同,则分别为阳离子和阴离子。
(1)原子次外层电子数与最外层电子数之差等于电子层数,若最外层为第二层,最外层电子数为2+2=4,为C;若为第三层,最外层电子数为8-3=5,为P;
(2)B的二价阴离子的核外电子排布与Ar的核外电子排布相同,则B有16个质子,为S,离子的电子式为![]() ;
;
(3)两种元素原子的最外层电子数相同,则两元素为同主族元素,两元素为一种金属元素和一种非金属元素,金属元素有Li、Be、Na、Mg、Al,同族符合条件的为B、Al,原子结构示意图分别为![]() 、
、![]() ;
;
(4)简单离子为单原子离子,电荷种类不同,则分别为阳离子和阴离子;电荷数量及最外层电子数不同,可以是H+和O2-,或Li+和O2-,或Be2+和Cl-,或H-和Mg2+等。H-和Mg2+的电子式分别为![]() 、Mg2+。
、Mg2+。

 阅读快车系列答案
阅读快车系列答案