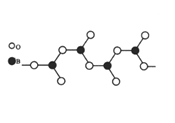
题目内容
【题目】下列说法正确的是( )
A.MgF2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
【答案】C
【解析】解:A、MgF2晶体中的化学键是离子键,而不是离子键,故A错误;
B、金属在熔融态能导电,不含离子键,故B错误;
C、N2分子中是氮氮叁键,而Cl2分子中氯氯单键,所以每个原子的最外层都具有8电子稳定结构,故C正确;
D、干冰是分子晶体,其溶于水生成碳酸的过程中伴有化学键的断裂与形成,所以不仅是克服分子间作用力,故D错误;
故选C.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
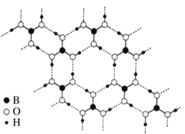
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________;同一片层划分出的一个二维晶胞(平行四边形)含有_______个H3BO3分子。
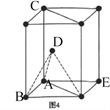
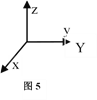
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________
【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.7kJ·mol-1
CH3OH(g) △H2=-90.7kJ·mol-1
③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。反应③中的相关的化学健键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ mol-1) | 436 | 343 | 465 | 453 | 413 |
则△H1=_________kJ·mol-1 △H3=_________ kJ·mol-1
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变

(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___v(逆),说明原因____________________。