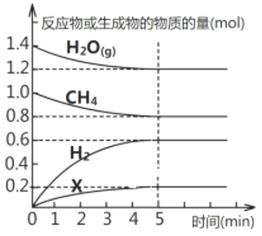
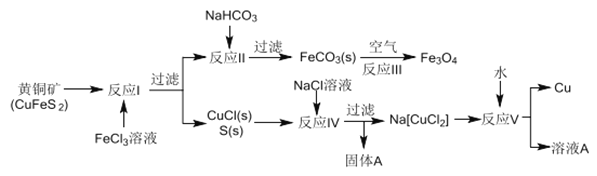
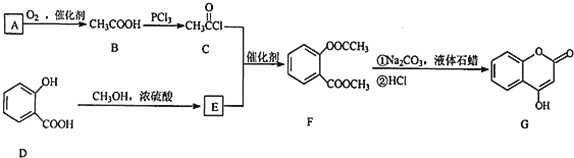
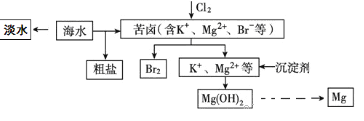
��Ŀ����
����Ŀ��1915��ŵ��������ѧ������Henry Bragg �� Lawrence Bragg���Ա���������X���߶Ծ���ṹ�ķ��������Ĺ��ס�
��1����ѧ��ͨ��X����̽����NaCl��KCl��MgO��CaO����ṹ���ƣ��������־���ľ������������±���
���� | NaCl | KCl | CaO |
������/��kJ��mol1�� | 786 | 715 | 3401 |
���־���NaCl��KCl��MgO��CaO�۵��ɸߵ��͵�˳����______��Na������__________�ֲ�ͬ���ܼ���
��2����ѧ��ͨ��X�����Ʋ���мȺ�����λ�����ֺ����������ṹʾ��ͼ������ͼ��ʾ��������λ����������������߱�ʾ��

��SO42 ��S���ӻ�������____________�����以Ϊ�ȵ������������___________����д������
����֪ [Cu(NH3)4]2+ ���жԳƵĿռ乹�ͣ�[Cu(NH3)4]2+ �е�����NH3�� Cl ȡ�����ܵõ����ֲ�ͬ�ṹ�IJ����[Cu(NH3)4]2+�Ŀռ乹��Ϊ_______________��
��д����̬Cu2+ �ļ۲�����Ų�ʽ��_________������ͭ��ȡ_________�ѻ���ʽ����֪Cuԭ�ӵİ뾶Ϊ r pm��NA ��ʾ�����ӵ�������ֵ������ͭ���ܶ���_______________g/cm3���г�����ʽ��
���𰸡� MgO > CaO > NaCl > KCl 4 sp3 ClO4��PO43 ƽ�������� 3d9 �������� ![]()
����������1�����Ӱ뾶��С˳��ΪMg2+ < Na+ < O2- < Ca2+< Cl- �����ӵ������Na+= Cl-< O2-= Mg2+= Ca2+�����Ӿ�������Ӱ뾶ԽС�������Խ����������Խ����������۷е��Խ������NaCl��KCl��MgO��CaO�۵��ɸߵ��͵�˳��Ϊ��MgO > CaO > NaCl > KCl��ԭ����û���˶�״̬��ͬ�ĵ��ӣ�Naԭ�Ӻ�����11�����ӣ��ʺ�����11�ֲ���ͬ�˶�״̬�ĵ��ӣ���ԭ�Ӻ�����ӷֱ���1s��2s��2p��3s�ܼ�������4�ֲ�ͬ�����ĵ�������ȷ����MgO > CaO > NaCl > KCl��4��
��2����SO42-�����к���4��������û���µ��Ӷ������������幹����������������ԭ�Ӳ�ȡsp3�ӻ������以Ϊ�ȵ������������ClO4��PO43 ������ȷ����sp3��ClO4��PO43 ��
��Cu2+��NH3֮���γ�4����λ�������жԳƵĿռ乹�ͣ�����Ϊƽ�������λ�����������������Ϊ��������������[Cu��NH3��4]2+�е�����NH3������Cl-ȡ����ֻ��һ�ֽṹ������ӦΪƽ�������Σ���ȷ�𰸣�ƽ����������
��Cu��29��Ԫ�أ�ԭ�Ӻ��������Ϊ29��ͭ�Ļ�̬ԭ�Ӽ۵��������Ų�ʽ3d104s1��ʧȥ2�����Ӻ��̬Cu2+ �ļ۲�����Ų�ʽ3d9��ͭ��������������ܶѻ���ʽ��ͭԭ�Ӱ뾶Ϊr��10-10cm��������ⳤΪx����2x2=��4r��10-10��2������x=2![]() r��10-10cm�����Ծ��������V=x3=��2
r��10-10cm�����Ծ��������V=x3=��2![]() r��10-10��3cm3�������к��е�ͭԭ����ĿΪ8��(1/8) +6��(1/2)=4�����Ծ���������Ϊ4��Mr/NAg�����Ծ�����ܶ�Ϊ=
r��10-10��3cm3�������к��е�ͭԭ����ĿΪ8��(1/8) +6��(1/2)=4�����Ծ���������Ϊ4��Mr/NAg�����Ծ�����ܶ�Ϊ= ![]() g/cm3�� ��ȷ����3d9 ���������� ��
g/cm3�� ��ȷ����3d9 ���������� �� ![]() ��
��

 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д�����Ŀ���¶�ΪTʱ����������ʼ�ݻ���Ϊ1L�ĺ����ܱ�����������Ӧ��H2(g)+I2(g) ![]() 2HI(g) ��H��0��ʵ���ã�v����v(H2)������v(I2)������k��c(H2)��c(I2)��v����v(HI)������k��c2 (HI)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
2HI(g) ��H��0��ʵ���ã�v����v(H2)������v(I2)������k��c(H2)��c(I2)��v����v(HI)������k��c2 (HI)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
���� | ���ʵ���ʼŨ�ȣ�mol��L��1�� | ���ʵ�ƽ��Ũ�� | ||
c(H2) | c(I2) | c(HI) | ||
�������ݣ� | 0.1 | 0.1 | 0 | c(I2)��0.07 mol��L��1 |
������ѹ�� | 0 | 0 | 0.6 | |
A. ��Ӧ�����У����������������е���ѹǿ�ı�Ϊ1:3
B. ��������ƽ��ʱ��c(HI��������)��3c(HI��������)
C. �¶�һ�����������з�Ӧ�ﵽƽ��ʱ��ƽ�ⳣ��ΪK������K��![]() ����
����
D. ��ƽ��ʱ������������ͬʱ��ͨ��0.1 mol I2��0.1 mol HI�����ʱ����������