题目内容
设似表示阿伏加德罗常数的值,下列说法正确的是( )A.在1molCaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA
B.0.1molC2H5OH中所含C-H键的数目为0.6NA
C.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
D.78gNa2O2与足量水反应转移的电子数为2NA
【答案】分析:A、CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中阴阳离子个数比都是1:1,再根据N=nNA计算;
B、一个C2H5OH分子中含有5个C-H键,再根据N=n NA计算;
C、根据N=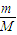 NA结合分子构成计算;
NA结合分子构成计算;
D、根据过氧化钠与转移电子之间的关系计算;
解答:解:A、CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中阴阳离子个数比都是1:1,与各物质的物质的量的多少无关,所以1molCaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为2NA,故A错误;
B、一个C2H5OH分子中含有5个C-H键,所以0.1molC2H5OH中所含C-H键的数目为0.5 NA,故B错误;
C、S2和S8是S的同素异形体,S2和S8的相对分子质量之比为1:4,原子个数比之比为1:4,所以把S2和S8的混合物当作纯净物S2计算,所含原子数=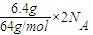 =0.2NA,故C正确;
=0.2NA,故C正确;
D、2Na2O2+2H2O=4NaOH+O2↑ 转移电子
78g 2 NA
78g 2 NA
故D正确.
故选CD.
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,易错选项是C,明确分子的构成是解本题的关键.
B、一个C2H5OH分子中含有5个C-H键,再根据N=n NA计算;
C、根据N=
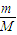 NA结合分子构成计算;
NA结合分子构成计算;D、根据过氧化钠与转移电子之间的关系计算;
解答:解:A、CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中阴阳离子个数比都是1:1,与各物质的物质的量的多少无关,所以1molCaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为2NA,故A错误;
B、一个C2H5OH分子中含有5个C-H键,所以0.1molC2H5OH中所含C-H键的数目为0.5 NA,故B错误;
C、S2和S8是S的同素异形体,S2和S8的相对分子质量之比为1:4,原子个数比之比为1:4,所以把S2和S8的混合物当作纯净物S2计算,所含原子数=
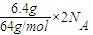 =0.2NA,故C正确;
=0.2NA,故C正确;D、2Na2O2+2H2O=4NaOH+O2↑ 转移电子
78g 2 NA
78g 2 NA
故D正确.
故选CD.
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,易错选项是C,明确分子的构成是解本题的关键.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
设似表示阿伏加德罗常数的值,下列说法正确的是 ( )
| A.在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA |
| B.0.1 mol C2H5OH中所含C-H键的数目为0.6NA |
| C.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| D.78gNa2O2与足量水反应转移的电子数为2NA |