题目内容
(1)每天消耗含95%的固体硫多少吨?
(2)理论上应安装多少台送风机?
(3)固体硫充分燃烧后的混合气体中氧气的体积分数ф(O2)的下限为多少?
(4)实际安装送风机的台数应略多于理论数(不考虑损坏),为什么?能否过分增加送风机的台数,为什么?(转化过程不考虑损耗;固体硫中杂质与空气不反应;空气中氧气的体积分数为21%)。
(1)设需固体硫的质量为x。由关系式法:
S——————H2SO4
32 98
x×95% 50t×98% 得x=16.8t
(2)由反应原理:S+O2=SO2, SO2+1/2O2≒ SO3,SO3+H2O=H2SO4,可得总反应式:S+3/2O2+H2O=H2SO4,n(O2)=n(H2SO4) ×3/2=50×106g×98%÷98g·mol-1×3/2=7.5×105mol。故理论上需安装送风机的台数为:
(7.5×105mol×22.4L·mol-1)×10-3m3·L-1÷(5000m3/台×21%)=16台。
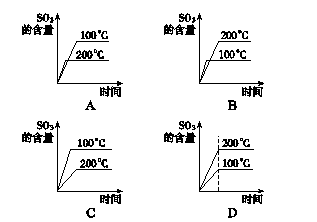
(3)硫充分燃烧后,混合气体中氧气的体积至少要保证反应SO2+1/2O2≒ SO3所需的氧气。设S燃烧生成的二氧化硫为1体积,则需消耗氧气1体积;催化氧化为三氧化硫需氧气0.5体积;空气带入的氮气为1.5体积×79/21=5.64体积,故混合气体中ф(O2)=(0.5/0.5+1+5.64)×100%=7%(下限)
(4)实际安装送风机台数略多于理论数的原因是:增大空气(氧气)的量,有利于平衡2SO2+O2≒ 2 SO3向右移动,从而提高二氧化硫的转化率。但过分增加空气的量,会带走热交换器的热量,降低反应的速率,不利于工业生产。
S——————H2SO4
32 98
x×95% 50t×98% 得x=16.8t
(2)由反应原理:S+O2=SO2, SO2+1/2O2≒ SO3,SO3+H2O=H2SO4,可得总反应式:S+3/2O2+H2O=H2SO4,n(O2)=n(H2SO4) ×3/2=50×106g×98%÷98g·mol-1×3/2=7.5×105mol。故理论上需安装送风机的台数为:
(7.5×105mol×22.4L·mol-1)×10-3m3·L-1÷(5000m3/台×21%)=16台。
(3)硫充分燃烧后,混合气体中氧气的体积至少要保证反应SO2+1/2O2≒ SO3所需的氧气。设S燃烧生成的二氧化硫为1体积,则需消耗氧气1体积;催化氧化为三氧化硫需氧气0.5体积;空气带入的氮气为1.5体积×79/21=5.64体积,故混合气体中ф(O2)=(0.5/0.5+1+5.64)×100%=7%(下限)
(4)实际安装送风机台数略多于理论数的原因是:增大空气(氧气)的量,有利于平衡2SO2+O2≒ 2 SO3向右移动,从而提高二氧化硫的转化率。但过分增加空气的量,会带走热交换器的热量,降低反应的速率,不利于工业生产。
(1)设需固体硫的质量为x。由关系式法:
S——————H2SO4
33 98
x×95% 50t×98% 得x=16.8t
(2)由反应原理:S+O2=SO2, SO2+1/2O2≒ SO3,SO3+H2O=H2SO4,可得总反应式:S+3/2O2+H2O=H2SO4,n(O2)=n(H2SO4) ×3/2=50×106g×98%÷98g·mol-1×3/2=7.5×105mol。故理论上需安装送风机的台数为:
(7.5×105mol×22.4L·mol-1)×10-3m3·L-1÷(5000m3/台×21%)=16台。
(3)硫充分燃烧后,混合气体中氧气的体积至少要保证反应SO2+1/2O2≒ SO3所需的氧气。设S燃烧生成的二氧化硫为1体积,则需消耗氧气1体积;催化氧化为三氧化硫需氧气0.5体积;空气带入的氮气为1.5体积×79/21=5.64体积,故混合气体中ф(O2)=(0.5/0.5+1+5.64)×100%=7%(下限)
(4)实际安装送风机台数略多于理论数的原因是:增大空气(氧气)的量,有利于平衡2SO2+O2≒ 2 SO3向右移动,从而提高二氧化硫的转化率。但过分增加空气的量,会带走热交换器的热量,降低反应的速率,不利于工业生产。
本题涉及到化工生产的反应原理、条件控制及计算,具有一定的开放性和研究性,代表了新教材的新理念。
S——————H2SO4
33 98
x×95% 50t×98% 得x=16.8t
(2)由反应原理:S+O2=SO2, SO2+1/2O2≒ SO3,SO3+H2O=H2SO4,可得总反应式:S+3/2O2+H2O=H2SO4,n(O2)=n(H2SO4) ×3/2=50×106g×98%÷98g·mol-1×3/2=7.5×105mol。故理论上需安装送风机的台数为:
(7.5×105mol×22.4L·mol-1)×10-3m3·L-1÷(5000m3/台×21%)=16台。
(3)硫充分燃烧后,混合气体中氧气的体积至少要保证反应SO2+1/2O2≒ SO3所需的氧气。设S燃烧生成的二氧化硫为1体积,则需消耗氧气1体积;催化氧化为三氧化硫需氧气0.5体积;空气带入的氮气为1.5体积×79/21=5.64体积,故混合气体中ф(O2)=(0.5/0.5+1+5.64)×100%=7%(下限)
(4)实际安装送风机台数略多于理论数的原因是:增大空气(氧气)的量,有利于平衡2SO2+O2≒ 2 SO3向右移动,从而提高二氧化硫的转化率。但过分增加空气的量,会带走热交换器的热量,降低反应的速率,不利于工业生产。
本题涉及到化工生产的反应原理、条件控制及计算,具有一定的开放性和研究性,代表了新教材的新理念。

练习册系列答案
相关题目
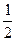 O2(g)
O2(g) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)