题目内容
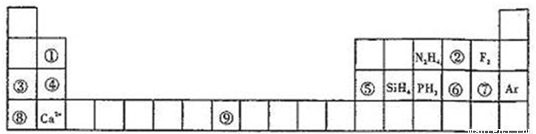
元素周期表揭示了许多元素的相似性和递变规律,同一周期元素构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒.如下列周期表中所示的一些分子或离子.
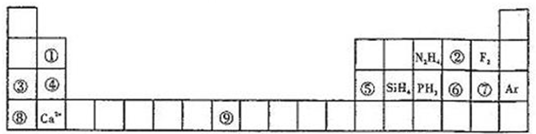
(1)写出⑨元素的原子核外电子排布式______.
(2)比较③、⑤分别与⑦形成的化合物水溶液的pH大小______>______(写化学式).
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式______.
(4)含有⑥元素的某种18电子的离子和H+及OH-均可发生反应,分别写出反应的离子方程式:
______,______.

(1)写出⑨元素的原子核外电子排布式______.
(2)比较③、⑤分别与⑦形成的化合物水溶液的pH大小______>______(写化学式).
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式______.
(4)含有⑥元素的某种18电子的离子和H+及OH-均可发生反应,分别写出反应的离子方程式:
______,______.
(1)⑨的原子序数为26,为Fe元素,基态原子的核外电子排布为1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2))③为Na,⑤为Al,⑦为Cl元素,对应的化合物分别为NaCl和AlCl3,其中NaCl为强酸强碱盐,溶液呈中性,AlCl3为
强酸弱碱盐,溶液呈酸性,则水溶液的pH:NaCl>AlCl3,
故答案为:NaCl;AlCl3;
(3)①为Be,⑤为Al,二者处于对角线位置,性质相似,则Be(OH)2为两性氢氧化物,能与强碱反应生成盐和水,Be(OH)2与NaOH反应的化学方程式为
Be(OH)2+2NaOH=Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O;
(4)⑥为S,对应18电子的离子和H+及OH-均可发生反应,应为HS-,反应的离子方程式分别为HS-+H+=H2S↑;HS-+OH-=S2-+H2O,
故答案为:HS-+H+=H2S↑;HS-+OH-=S2-+H2O.
故答案为:1s22s22p63s23p63d64s2;
(2))③为Na,⑤为Al,⑦为Cl元素,对应的化合物分别为NaCl和AlCl3,其中NaCl为强酸强碱盐,溶液呈中性,AlCl3为
强酸弱碱盐,溶液呈酸性,则水溶液的pH:NaCl>AlCl3,
故答案为:NaCl;AlCl3;
(3)①为Be,⑤为Al,二者处于对角线位置,性质相似,则Be(OH)2为两性氢氧化物,能与强碱反应生成盐和水,Be(OH)2与NaOH反应的化学方程式为
Be(OH)2+2NaOH=Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O;
(4)⑥为S,对应18电子的离子和H+及OH-均可发生反应,应为HS-,反应的离子方程式分别为HS-+H+=H2S↑;HS-+OH-=S2-+H2O,
故答案为:HS-+H+=H2S↑;HS-+OH-=S2-+H2O.

练习册系列答案
相关题目

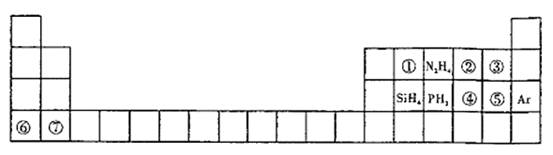
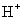 和
和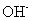 均可发生反应,写出其与
均可发生反应,写出其与