题目内容
9.氨是重要的氮肥,合成原理为:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-92.4kJ•mol-1.回答下列问题:在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图1所示,回答下列问题: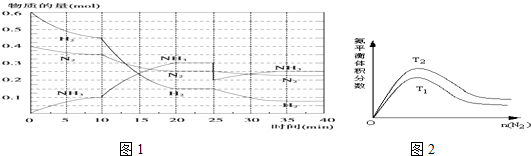
(1)10min内 以NH3表示的平均反应速率为0.005mol/(L.min)
(2)在10~20min内,NH3浓度变化的原因可能是A
A.使用了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第2次平衡时NH3的体积分数45.5%;
(4)在反应进行至25min时,曲线发生变化的原因:分离出0.1molNH3达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“小于”或“等于”).
(5)一定条件下NH3的平衡体积分数随n(N2)变化如图2所示 (T-温度).则T2<T1 (填>、=、<),判断的依据是:合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2.
分析 (1)反应速率=$\frac{\frac{△n}{V}}{△t}$计算;
(2)根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
(3)第2次平衡时NH3的体积分数等于氨气的含量;
(4)25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,平衡常数仅与温度有关;
(5)对于放热反应,升高温度,化学平衡向着吸热方向即逆反应方向进行.
解答 解:(1)反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.1-0)mol}{2L}}{10min}$=0.005mol/(L.min),
故答案为:0.005mol/(L.min);
(2)由图可知,0-10分钟内△n(N2)=0.025mol×2=0.05mol;10-20分钟内△n′(N2)=0.025mol×4=0.1mol,速率之比等于物质的量之比,所以,0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;
由图象可知各组分物质的量变化增快,且10min时变化是连续的,20min达平衡时,△n′(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,
故选A;
(3)第2次平衡时NH3的体积分数=$\frac{2.5mol}{2.5mol+2.25mol+0.75mol}$=45.5%,
故答案为:45.5%;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,因为平衡常数仅与温度有关,所以K2等于K1;
故答案为:分离出0.1molNH3;等于;
(5)合成氨反应是放热反应,随着反应进行,体系温度逐渐升高,所以化学平衡会逆向移动,导致NH3的体积分数下降,即温度越高,NH3的体积分数越小,所以T2<T1,
故答案为:<;合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2.
点评 本题考查化学平衡的计算、平衡移动以及平衡状态的判断,题目难度中等,注意对图象的分析.

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 硫酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 | |
| B. | 6.02×1023个N2和6.02×1023个O2的质量比等于7:8 | |
| C. | 常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44 g | |
| D. | 3.2 g O2所含的原子数目约为0.2×6.02×1023 |

| A. | 该系统中只存在3种形式的能量转化 | |
| B. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X能实现燃料电池的燃料再生 |

