题目内容
8.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的c.
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH.
(2)电解池阳极能同时发生了两个电极反应(阳极上还会产生微量气泡),电极反应式分别是:Ⅰ.Fe-2e-=Fe2+;Ⅱ.2H2O-4e-=4H++O2↑;
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.
①负极的电极反应是CH4+4CO32--8e-=5CO2+2H2O;
②正极的电极反应是O2+2CO2+4e-=2CO32-;
③为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见如图).A物质的化学式是CO2.
分析 (1)从所加入物质能增大溶液离子浓度,并能保持污水的pH在5.0~6.0之间考虑;
(2)根据阳极电极材料和离子的放电顺序考虑放电的离子,并书写电极反应式;
(3)①燃料电池中,负极上是燃料发生失电子的氧化反应;
②燃料电池中,正极发生的反应是氧气得电子被还原的过程;
③根据两极上发生的反应确定循环使用的物质.
解答 解:(1)为了增强溶液的导电性,因此可选用易溶性强电解质溶液,排除B,考虑到题中要求电解时保持污水的pH在5.0~6.0之间,因此不能添加NaOH,硫酸会和Fe(OH)3反应,不能使用,故答案为:c;
(2)电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2,故答案为:Fe-2e-=Fe2+;2H2O-4e-=4H++O2↑;
(3)①燃料电池中,负极上是燃料发生失电子的氧化反应,发生的电极反应为:CH4+4CO32--8e-=5CO2+2H2O,故答案为:CH4+4CO32--8e-=5CO2+2H2O;
②正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
③由电极反应可知电池工作时参加循环的物质为CO2,故答案为:CO2.
点评 本题考查原电池和电解池的知识,较为综合,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写.

练习册系列答案
相关题目
18.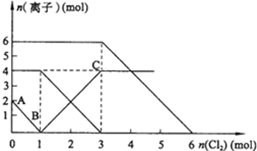 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )| A. | BC段为Fe3+的变化曲线 | |
| B. | 原混合溶液中FeBr2的物质的量为6mol | |
| C. | 当通入2mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
19.下列有关化学实验的叙述正确的是( )
| A. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| B. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 | |
| C. | 用待测液润洗滴定用的锥形瓶 | |
| D. | Na2CO3溶液保存在带玻璃塞的试剂瓶中 |
16.乙烷受热分解生成乙烯和氢气,取1体积分解后混合气使其充分燃烧生成1.6体积的二氧化碳气体(在相同条件下测定),则乙烷的分解率为( )
| A. | 20% | B. | 25% | C. | 50% | D. | 75% |
3.某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:探究同一周期主族元素性质的递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液等.仪器:①烧杯,②试管,③胶头滴管,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
(4)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的相对强弱,请你设计实验(实验用品自选,不要求写化学方程式):向溶液中滴加NaOH溶液至过量,得白色沉淀,不溶解;向溶液中滴加NaOH溶液至过量,产生白色胶状沉淀,继而沉淀消失;.
(5)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
(1)实验目的:探究同一周期主族元素性质的递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液等.仪器:①烧杯,②试管,③胶头滴管,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
(5)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
18.有关氨气的性质、应用错误的是( )
| A. | 氨气是一种有强烈刺激气味的气体 | |
| B. | 氨气能被氧化为NO,是工业生产硝酸的重要原料之一 | |
| C. | 铵盐易和碱反应生成具有挥发性的氨气,在实验室中用NH4Cl和Ca(OH)2的混合物制取氨气 | |
| D. | 氨气极易溶于水,可用作制冷剂 |
 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目: .
.