��Ŀ����
����Ŀ���⼰�仯������������ռ����Ҫ��λ����֪��ӦH2(g) + I2(g)![]() 2HI(g) ��H=��11 kJ��mol��1��716Kʱ����һ�ܱ������а����ʵ�����1:1����H2(g)��I2(g)��������������е⻯������ʵ��������뷴Ӧʱ��Ĺ�ϵ����ͼ��
2HI(g) ��H=��11 kJ��mol��1��716Kʱ����һ�ܱ������а����ʵ�����1:1����H2(g)��I2(g)��������������е⻯������ʵ��������뷴Ӧʱ��Ĺ�ϵ����ͼ��

(1)����Ӧ��ʼʱ�����������ѹΪp kPa����Ӧ��ǰ20 min�ڵ�ƽ������![]() (HI)=_____kPa��min��1(�ú�p��ʽ�ӱ�ʾ)��
(HI)=_____kPa��min��1(�ú�p��ʽ�ӱ�ʾ)��
(2)��Ӧ��ƽ��ʱ��H2��ת������(H2)=____________��
(3)������Ӧ�У�����Ӧ����Ϊv��= k����c(H2)��c(I2)���淴Ӧ����Ϊv��=k����c2(HI)������k����k��Ϊ���ʳ����������¶ȣ�![]() ________(��������������С������������)��
________(��������������������������)��
(4)�����¶ȣ�ƽ����������ƶ���ԭ����__________��
(5)1 mol H2(g)�����л�ѧ������ʱ��Ҫ����436 kJ����������ͼ�е���H2=________kJmol��1


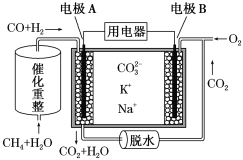
(6)��������������ʽ�����������Ʊ������װ�ü���ʼ�ĵ������Һ����ͼ��ʾ��
�������缫��ӦʽΪ______________��
����Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ����AĤΪ��Ĥ����BĤΪ______Ĥ��CĤΪ______Ĥ��
���𰸡�0.03 p 78.4% ��С ����ʹ��������Ϊ��̬����̬��Ũ�Ƚ���ƽ�������ƶ� ��162 2H2O��4e��===4H����O2�� �� ��
��������
��1���г�����ʽ���������ʹ�ʽ���㣻
��2������ת���ʹ�ʽ���㣻
��3������ƽ��ʱ�������淴Ӧ������ȣ�![]() ����Ӧ��ƽ�ⳣ����H2(g) + I2(g)
����Ӧ��ƽ�ⳣ����H2(g) + I2(g)![]() 2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���
2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���![]() ��С��
����
��4�������¶ȣ�ƽ����������ƶ���ԭ���ǣ�����ʹ��������Ϊ��̬��
��5����ͼ���ݸ�˹���ɼ��㣻
��6����ˮ����������������Ӧ����������
����Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ����AĤΪ��Ĥ����������ͨ������BĤΪ��Ĥ������������ͨ����CĤΪ��Ĥ������������ͨ����
��1��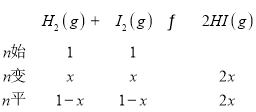
��ͼ![]() ��x=0.6��
��x=0.6��
![]() (HI)=
(HI)=![]() ==0.03pkPa��min��1
==0.03pkPa��min��1
��2����Ӧ��ƽ��ʱ��HI���������Ϊ0.784��![]() ��x=0.784��H2��ת������(H2)=
��x=0.784��H2��ת������(H2)=![]() =78.4%��
=78.4%��
��3������ƽ��ʱ�������淴Ӧ������ȣ�����Ӧ����Ϊv��= k����c(H2)��c(I2)���淴Ӧ����Ϊv��=k����c2(HI)��v��= k����c(H2)��c(I2)=k����c2(HI)=v����![]() =
=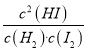 =K��H2(g) + I2(g)
=K��H2(g) + I2(g)![]() 2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���
2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���![]() ��С��
����
��4�������¶ȣ�ƽ����������ƶ���ԭ���ǣ�����ʹ��������Ϊ��̬����̬��Ũ�Ƚ���ƽ�������ƶ���
��5��1 mol H2(g)�����л�ѧ������ʱ��Ҫ����436 kJ����������ͼ��H3=587kJmol��1��1 mol I2(g)�����л�ѧ������ʱ��Ҫ����587KJ-436 kJ=151KJ������������H2=151kJmol��1������H1+��H2=��H����H2=��H-��H1=��-11-151��kJmol��1=-162kJmol��1��
��6����ˮ����������������Ӧ���������������缫��ӦʽΪ2H2O��4e��===4H����O2����
����Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ����AĤΪ��Ĥ����������ͨ������BĤΪ��Ĥ������������ͨ����CĤΪ��Ĥ������������ͨ����

 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д�����Ŀ��ij�¶��£���Ӧ2CH3OH(g)![]() CH3OCH3(g) + H2O(g)��ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ��Ϊ������Ӧ�����ݡ�����˵����ȷ����
CH3OCH3(g) + H2O(g)��ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ��Ϊ������Ӧ�����ݡ�����˵����ȷ����
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/��mol��L-1�� | 0.44 | 0.6 | 0.6 |
A.CH3OH����ʼŨ��Ϊ1.04 mol/LB.ƽ��ʱCH3OH��Ũ��Ϊ0.04 mol/L
C.��ʱ�淴Ӧ���ʴ�������Ӧ����D.ƽ��ʱCH3OH��ת����С��80%