题目内容
【题目】在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1CuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1)发生氧化反应的是 极,电极反应式为 。
(2)若电解后溶液的体积不变,则电解后溶液的H+浓度为 。
(3)若将溶液恢复到与电解前一样,则需加入 mol的 。
【答案】
(1)阳极,4OH--4e-=O2+2H2O
(2)0.1mol/L
(3)0.1 CuO或CuCO3
【解析】
试题分析:在25℃时,用石墨电极电解2.0 L,0.5mol/LCuSO4溶液中Cu2+物质的量为0.5mol,5min后,在一个石墨电极上有6.4 g Cu生成物质的量为0.1mol。
(1)电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑,故答案为:阳;4OH--4e-═2H2O+O2↑;
(2)依据电极反应电子守恒,生成铜物质的量为0.1mol,电子转移为0.2mol;
阳极反应为:4OH- - 4e-═2H2O+O2↑
0.2mol 0.2mol 0.05mol
阴极反应为:2Cu2+ + 4e- ═ 2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中电子转移为0.2mol;生成氧气的体积=0.05mol×22.4L/mol=1.12L;减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=![]() =0.1mol/L,故答案为:0.1mol/L;
=0.1mol/L,故答案为:0.1mol/L;
(3)根据电解的离子方程式2Cu2++2H2O![]() 2Cu+O2↑+4H+,反应生成铜的物质的量为:0.1mol,生成氧气的物质的量为:0.1mol×
2Cu+O2↑+4H+,反应生成铜的物质的量为:0.1mol,生成氧气的物质的量为:0.1mol×![]() =0.05mol,相当于减少了0.1molCuO,故答案为:0.1;CuO或CuCO3。
=0.05mol,相当于减少了0.1molCuO,故答案为:0.1;CuO或CuCO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
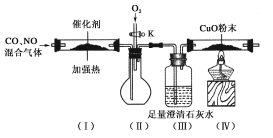
小学生10分钟应用题系列答案【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH = a kJ/mol
COCl2(g) ΔH = a kJ/mol
反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比较各时段平均速率v(COCl2):
v(0-1) _________v(0-2);v(0-2) _________v(1-2) (填“>”、“=”或“<”)。
(2)在2min~4min间,v(Cl2)正_____________v(Cl2)逆 (填“>”、“=”或“<”),该温度下K =____________
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系。
X代表的物理量是_____________;a____________0(填“>”,“=”,“<”),依据是 。