题目内容
【题目】实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.请用下列装置设计一个实验,以测定SO2转化为SO3的转化率: 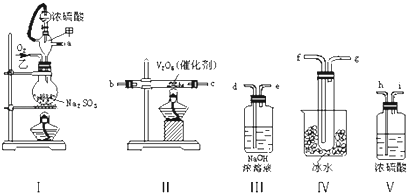
(1)这些装置的连接顺序(按气体左右的方向)是→→→→→→→(填各接口的编号).
(2)实验时甲仪器橡胶支管的作用与原理是 .
(3)从乙处均匀通入O2 , 为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 .
(4)Ⅳ处观察到的现象是 .
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会(填“增大”“不变”或“减小”).
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 .
【答案】
(1)a;h;i;b;c;f;g;d
(2)使浓硫酸能顺利地滴入烧瓶中;维持烧瓶内压强与分液漏斗上方压强相等
(3)先加热V2O5 , 后缓缓滴入浓硫酸
(4)有无色(或白色)晶体(或固体)生成
(5)减小
(6)![]() ×100%
×100%
【解析】解:(1)因从溶液中反应生成气体中混有水蒸气,所以产生的气体首先经过干燥装置Ⅲ,然后再进行二氧化硫气体的催化氧化即经过装置Ⅱ,然后是收集S03 , S03的熔点是16.8℃,沸点是44.8℃,所以选择装置Ⅳ进行冷却,使三氧化硫与二氧化硫分离,最后在Ⅴ中吸收未反应的SO2 , 要制备二氧化硫并检验二氧化硫的性质、收集二氧化硫,依次用到的装置为:Ⅰ气体发生装置,Ⅴ干燥装置,Ⅱ为二氧化硫催化氧化装置,Ⅳ收集装置,Ⅲ尾气吸收装置,所以正确的顺序为:a h i b c f g d;所以答案是:a h i b c f g d;(2)甲仪器中橡皮管将分液漏斗与圆底烧瓶相连,使二者压强相等,有利于浓硫酸顺利滴入到烧瓶中; 所以答案是:使浓硫酸能顺利地滴入烧瓶中;维持烧瓶内压强与分液漏斗上方压强相等;(3)为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热V2O5 , 后缓缓滴入浓硫酸,所以答案是:先加热V2O5 , 后缓缓滴入浓硫酸; (4)装置IV处是用来冷却三氧化硫气体,使之变成液态或固态,从而收集得到三氧化硫,所以可以在Ⅳ处看到有无色(或白色)晶体(或固体)生成,所以答案是:有无色(或白色)晶体(或固体)生成;(5)大火加热,生成二氧化硫较快,不能充分反应,则转化率减小,所以答案是:减小;(6)n mol Na2SO3粉末与足量浓硫酸反应生成nmol二氧化硫,当反应结束时,Ⅲ处增重的部分为未反应的二氧化硫,则转化了的二氧化硫的质量为:64n﹣m,所以实验中SO2的转化率为 ![]() ×100%,所以答案是:
×100%,所以答案是: ![]() ×100%.
×100%.

 应用题作业本系列答案
应用题作业本系列答案