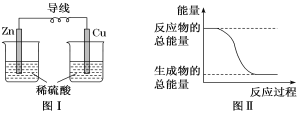
题目内容
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是( )

①铜为阳极,锌为阴极;②铜极上有气泡;③SO42-向铜极移动;④若有0.5 mol 电子流经导线,则可产生0.25 mol气体;⑤电子的流向是铜到锌;⑥正极反应式:Cu+2e-=Cu2+。
A. ①②③ B. ②④ C. ④⑤⑥ D. ④⑤
【答案】B
【解析】
①Cu为正极,Zn为负极,故①错误;
②Cu极上氢离子得电子生成氢气,铜极上有气泡,故②正确;
③SO42-向负极(Zn极)移动,故③错误;
④由2H++2e-=H2↑可知,若有0.5 mol电子流经导线,则可产生0.25 mol气体,故④正确;
⑤电子的流向是Zn→Cu,故⑤错误;.
⑥正极反应式:2H++2e-=H2↑,故⑥错误;②④正确,答案选B。

【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g)

(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(mol/L) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中H2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢