��Ŀ����
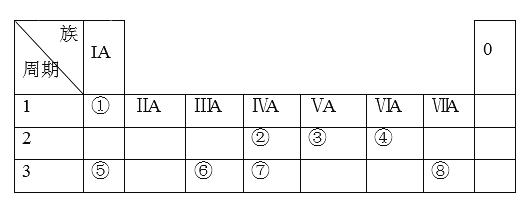
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�ص�ԭ��������������A��C��B��Eͬ���壬C��D��Eͬ���ڡ���A��B��ɵ����ֻ�������Ҷ�ΪҺ̬������A��Bԭ����֮��Ϊ2��1������Ϊ1��1����B��C��ɵ����ֻ�������Ͷ���Ϊ��̬������C��Bԭ����֮��Ϊ2��1������Ϊ1��1��C��D��E������������Ӧ��ˮ��������֮����ܷ�����Ӧ���Ҿ��м����ɣ���AΪԭ�Ӱ뾶��С�Ķ�����Ԫ�أ���Ϊ����ɫ���塣��
��1��D��ԭ�ӽṹʾ��ͼΪ��__________________
��2��AԪ�صĵ���Ϊ��_____________���ѧʽ�������ĵ���ʽΪ��_____________
��3��E�����ڱ��е�λ��_________________________________
��4��C��D������������Ӧˮ�������Ӧ�����ӷ���ʽΪ��
____________________________________________________________��
���𰸡�  H2
H2 ![]() �������ڵ�VIA�� OH-+Al��OH��3=AlO2-+2H2O
�������ڵ�VIA�� OH-+Al��OH��3=AlO2-+2H2O
��������A��B��C��D��E���ֶ�����Ԫ�ص�ԭ��������������AΪԭ�Ӱ뾶��С�Ķ�����Ԫ����AΪHԪ�ء���A��B��ɵ����ֻ�������Ҷ�ΪҺ̬������A��Bԭ����֮��Ϊ2��1��ΪH2O������Ϊ1��1ΪH2O2����BΪOԪ�أ�A��C��B��Eͬ���壬��CΪNaԪ�أ�EΪSԪ�أ�C��D��Eͬ���ڡ���B��C��ɵ����ֻ�������Ͷ���Ϊ��̬������C��Bԭ����֮��Ϊ2��1��Ϊ�����ƣ�����Ϊ1��1����Ϊ����ɫ���壬Ϊ����������C��D��E������������Ӧ��ˮ��������֮����ܷ�����Ӧ���Ҿ��м����ɣ���DΪAlԪ�ء�
(1)DΪAlԪ����ԭ�ӽṹʾ��ͼΪ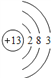 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2)AΪHԪ����AԪ�صĵ���ΪH2����Ϊ��������������ʽΪ![]() ���ʴ�Ϊ��H2��
���ʴ�Ϊ��H2��![]() ��
��
(3)EΪSԪ���������ڱ���λ�ڵ������ڵ�VIA�壬�ʴ�Ϊ���������ڵ�VIA�壻
(4)��������������������Ӧ�����ӷ���ʽΪOH-+Al(OH)3=AlO2-+2H2O���ʴ�Ϊ��OH-+Al(OH)3=AlO2-+2H2O��