题目内容
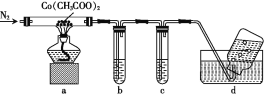
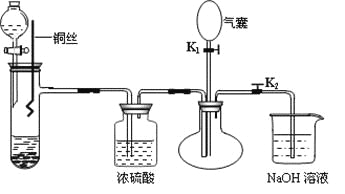
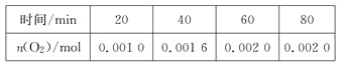
【题目】根据下图所示实验,回答问题:
(1)实验①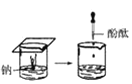 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②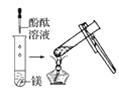 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③ 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④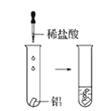 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
【答案】熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色 镁条溶解有无色气泡冒出 铝条缓慢溶解有无色气泡冒出 钠与冷水反应剧烈,镁与冷水几乎不反应,能与热水反应;镁、铝都能置换出酸中的氢,镁更容易 钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al 同周期元素(如钠、镁、铝),随着原子序数的递增,原子的核电荷数增多,原子半径减小,原子核对最外层电子的吸引力增强,失去最外层电子逐渐变难,元素的金属性逐渐减弱,最高价氧化物对应水化物的碱性逐渐减弱
【解析】
结合Na、Mg、Al的金属活泼性差异并参照金属性强弱的判断依据和元素周期律分析解答即可。
(1)实验①钠放入水中,反应后滴加酚酞试液可观察到的现象是熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红;实验②是水中加入镁粉并滴加酚酞,然后放在酒精灯上加热,实验过程中观察到的现象是加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色;
(2)实验③是向盛有镁块的试管中滴加稀盐酸,观察到的现象是镁条溶解有无色气泡冒出;实验④是向盛有铝块的试管中滴加稀盐酸,观察到的现象是铝条缓慢溶解有无色气泡冒出;
(3)由实验①②③④观察到的实验现象,可知钠与冷水反应剧烈,镁与冷水几乎不反应,能与热水反应;镁、铝都能置换出酸中的氢,镁更容易;
(4)Na、Mg、Al均为第三周期的主族元素,且核电荷数依次增大,由实验①②③④可得钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al,存在活泼性差异的原因是同周期元素(如钠、镁、铝),随着原子序数的递增,原子的核电荷数增多,原子半径减小,原子核对最外层电子的吸引力增强,失去最外层电子逐渐变难,元素的金属性逐渐减弱,最高价氧化物对应水化物的碱性逐渐减弱。