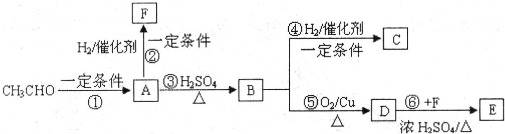
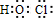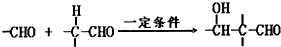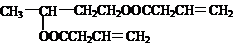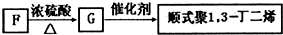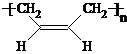题目内容
(2012?河东区一模)已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确盼是( )
|
分析:A.加水稀释醋酸溶液,能促进醋酸的电离,但醋酸根离子浓度减小;
B.少量二氧化碳和次氯酸钠反应生成碳酸氢钠和次氯酸;
C.二氧化硫和次氯酸钙反应生成硫酸钙;
D.弱酸的钠盐溶液中,酸越弱,其水解程度越大,则钠盐溶液的碱性越强.
B.少量二氧化碳和次氯酸钠反应生成碳酸氢钠和次氯酸;
C.二氧化硫和次氯酸钙反应生成硫酸钙;
D.弱酸的钠盐溶液中,酸越弱,其水解程度越大,则钠盐溶液的碱性越强.
解答:解:A.加水稀释醋酸溶液,能促进醋酸电离,但醋酸根离子增大程度小于溶液体积增大程度,所以醋酸根离子浓度减小,故A正确;
B.少量二氧化碳通入NaClO溶液中反应的离子方程式为:CO2+H2O+ClO-=HCO3+HClO,故B错误;
C.二氧化硫具有还原性,次氯酸根离子具有氧化性,二者能发生氧化还原反应生成硫酸根离子和氯离子,所以少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故C错误;
D.相同物质的量浓度的含有弱酸根离子的钠盐溶液,对应酸的酸性越弱则酸根离子水解程度越大,溶液中氢氧根离子浓度越大,PH越大,水解程度大小顺序是CH3COO-<SO3 2-<ClO-<CO32-,所以碱性最强的是碳酸钠溶液,故D错误;
故选A.
B.少量二氧化碳通入NaClO溶液中反应的离子方程式为:CO2+H2O+ClO-=HCO3+HClO,故B错误;
C.二氧化硫具有还原性,次氯酸根离子具有氧化性,二者能发生氧化还原反应生成硫酸根离子和氯离子,所以少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故C错误;
D.相同物质的量浓度的含有弱酸根离子的钠盐溶液,对应酸的酸性越弱则酸根离子水解程度越大,溶液中氢氧根离子浓度越大,PH越大,水解程度大小顺序是CH3COO-<SO3 2-<ClO-<CO32-,所以碱性最强的是碳酸钠溶液,故D错误;
故选A.
点评:本题考查弱电解质的电离、盐类的水解、氧化还原反应等知识点,易错选项是CD,注意二氧化硫能被次氯酸根离子氧化生成硫酸根离子,注意盐类水解程度大小的比较方法,为易错点.

练习册系列答案
相关题目
 (2012?河东区一模)A、B、C、D、E五种元素从左向右按原予序数递增(原子序数为5个连续的自然数)的顺序捧列如右:下列说法正确的是( )
(2012?河东区一模)A、B、C、D、E五种元素从左向右按原予序数递增(原子序数为5个连续的自然数)的顺序捧列如右:下列说法正确的是( )