题目内容
【题目】已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -1025kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) △H= -1025kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.  B.
B. 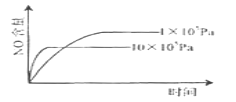
C.  D.
D. 
【答案】C
【解析】
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -1025kJ/mol,为放热反应,且正反应气体体积增大,利用勒夏特列原理分析解题。
4NO(g)+6H2O(g) △H= -1025kJ/mol,为放热反应,且正反应气体体积增大,利用勒夏特列原理分析解题。
A.从1000℃升温到1200℃, NO的含量降低,平衡逆向移动;温度升高,向吸热反应方向移动,逆反应为吸热反应,符合反应事实,A项不符合题意;
B. 从105Pa升压到106Pa,NO的含量降低,平衡逆向移动;压强增大,向气体体积减小的方向移动,符合反应事实,B项不符合题意;
C.从1000℃升温到1200℃,NO的含量增加,平衡正向移动;温度升高,向吸热反应方向移动,吸热反应为逆反应,不符合反应事实,C项符合题意;
D.1000℃有催化剂比无催化剂更快达到平衡,但是NO的含量一样,平衡没有移动。催化剂不改变平衡的移动,但是可以加快化学反应速率,符合反应事实,D项不符合题意;
本题答案选C。

练习册系列答案
相关题目