题目内容
【题目】①VLFe2(SO4)3中含有Fe3+mg,则SO42-的物质的量浓度为____________
②6.02×1024个Na+约含_______molNa+;4.5mol甲烷约含有_________个分子,其质量为________g;
3.01×1023个CO2在标准状况下体积是________L,它与__________gCO含有相同的氧原子数。
③将4ml37%的盐酸密度为(1.19g·cm-3)加水稀释到200ml,稀释后盐酸的物质的量浓度是__________。
④在标准状况下22.4L由氮气和氧气组成给的混合气体,其质量为30g,则其中氧气的质量为__________g。
⑤同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对体积分子质量为__________。
【答案】①3m/112000V mol/L(不写单位不给分);
②10;2.71×1024;72;11.2,28;③0.24mol/L;④ 16;⑤32
【解析】
试题分析:①VLFe2(SO4)3中含有Fe3+mg,物质的量为![]() ,根据硫酸铁的化学式可知硫酸根的物质的量是
,根据硫酸铁的化学式可知硫酸根的物质的量是![]() ,则SO42-的物质的量浓度为
,则SO42-的物质的量浓度为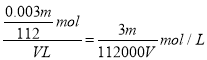 ;
;
②6.02×1024个Na+约含![]() Na+;4.5mol甲烷约含有
Na+;4.5mol甲烷约含有![]() 个分子,其质量为4.5mol×16g/mol=72g;3.01×1023个CO2在标准状况下体积是
个分子,其质量为4.5mol×16g/mol=72g;3.01×1023个CO2在标准状况下体积是![]() 。其中含有1mol氧原子,则它与28gCO含有相同的氧原子数。
。其中含有1mol氧原子,则它与28gCO含有相同的氧原子数。
③37%的盐酸密度为(1.19g·cm-3)的浓度为![]() =12mol/L。将4mL此浓盐酸加水稀释到200ml,即稀释了50倍,因此稀释后盐酸的物质的量浓度是12mol/L÷50=0.24mol/L。
=12mol/L。将4mL此浓盐酸加水稀释到200ml,即稀释了50倍,因此稀释后盐酸的物质的量浓度是12mol/L÷50=0.24mol/L。
④在标准状况下22.4L由氮气和氧气组成给的混合气体的物质的量是1mol,其质量为30g,因此混合气体的平均相对分子质量是30,则根据十字交叉法可知氮气和氧气的物质的量之比是![]() ,说明氧气是0.5mol,则其中氧气的质量为16g。
,说明氧气是0.5mol,则其中氧气的质量为16g。
⑤同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,二者的物质的量相等,A的物质的量是1g÷2g/mol=0.5mol,则A的相对分子质量为16÷0.5=32。
