题目内容
9.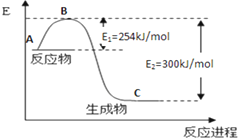 氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol.
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后△H不变 (填“增大”、“减小”、“不变”)
(4)用NH3催化还原NOX 氮氧化物的污染.例如
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol(用含a、b的式子表示)
分析 (1)据焓变等于反应物活化能减去生成物活化能求算焓变,再书写热化学方程式;
(2)根据反应热等于反应物的总键能减去生成物的总键能计算;
(3)反应热△H取决于反应物和生成物总能量的相对大小;
(4)利用盖斯定律计算.
解答 解:(1)据焓变等于反应物活化能减去生成物活化能求算焓变,N2和H2反应生成2mol NH3过程中的△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol,故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(2)反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则943+3×435-6x=-92,x=390,故答案为:390;
(3)反应热△H取决于反应物和生成物总能量的相对大小,加入催化剂,虽然反应物和生成物的活化能都降低,但反应物和生成物的能量不变,故反应热△H不变,
故答案为:不变;
(4)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
②N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
利用盖斯定律将$\frac{①-3②}{4}$可得NH3(g)+$\frac{3}{2}$NO(g)=$\frac{5}{4}$N2(g)+$\frac{3}{2}$H2O(g)△H3=$\frac{a-3b}{4}$kJ/mol,
故答案为:$\frac{a-3b}{4}$.
点评 本题考查综合考查化学反应与能量变化知识,注意物质的总能量、键能与反应热的计算关系,把握盖斯定律的计算方法,题目难度中等.

练习册系列答案
相关题目
19.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述正确的是( )
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够和氯气发生加成反应 | |
| D. | 丙烷的熔点比乙烷高 |
14.下列各能层中不包含p能级的是( )
| A. | N | B. | M | C. | L | D. | K |
1.X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R是气态物质 |
18.下表对某些反应方程式的评价合理的是( )
| 编号 | 离子方程式或电极反应式 | 评价 | |
| A | 次氯酸钙溶液中通入足量SO2 | Ca2++C1O-+SO2+H2O=CaSO4+ C1-+2H+ | 正确 |
| B | 硫酸铁溶液与氢氧化钡溶液混合 | Fe3++SO42-+Ba2++3OH-= Fe(OH)3↓+BaSO4↓ | 正确 |
| C | 醋酸铵溶于水 | CH3COO-+NH4+?CH3COOH+NH3•H2O | 错误,阴离子水解相互促进,应该用“=”号 |
| D | 用惰性电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:2Cu2++4e-=2Cu 阳极:4OH--4e-=2H2O+O2↑ | 错误,该阴阳两极反应不可能同时发生 |
| A. | A | B. | B | C. | C | D. | D |
19.我们在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”(见甲)的有机物,而与视黄醛相似结构的维生素A(见乙)常作为保健药物,则下列有关叙述正确的是( )

| A. | 视黄醛的分子式为C24H20O | |
| B. | 维生素A分子结构中含有苯环、碳碳双键和羟基 | |
| C. | 维生素A是视黄醛的氧化产物 | |
| D. | 1mol视黄醛在一定条件下最多能与8molH2发生反应 |

 .
.