题目内容
某种外围电子排布式为2s22p5的元素,下列有关它的描述正确的有
| A.原子序数为7 | B.在周期表中第一电离能最小 |
| C.在周期表中原子半径最小 | D.在周期表中电负性最大 |
D
解析试题分析:A、外围电子排布式为2s22p5的元素是F元素,原子序数是9,A不正确;B、F是最活泼的非金属,第一电离能不是最小的,B不正确;C、在周期表中原子半径最小的是氢元素,不正确;D、非金属性越强,电负性越大,D正确,答案选D。
考点:考查核外电子排布、元素周期律的应用
点评:该题是基础性试题的考查,试题紧扣教材,基础性强,难度不大。明确元素的核外电子排布规律和元素周期律是答题的关键。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述正确的是
| A.X分别和其它四种元素均可形成至少2种化合物 |
| B.M分别和W、X、Y、Z形成化合物,均显相同化合价 |
| C.M、X、Z三种元素组成的化合物含有离子键 |
| D.M、X、Y组成化合物和Y、Z组成化合物,其水溶液均呈碱性 |
下列说法正确的是( )
| A.第ⅠA族金属单质的密度、熔沸点均随着核电荷数的增大而递增 |
| B.金属锂在氧气中燃烧生成Li2O2 |
| C.金属的还原性:Li>Na>K>Rb |
| D.氢化物的稳定性: HF > HCl > HBr > HI |
随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+、等已被发现。下列有关说法中,正确的是( )
| A.H2与H3属于同素异形体 | B.O2与O4属于同位素 |
| C.C60的质量数为720g/mol | D.N5+离子中含有36个电子 |
下列关于元素的叙述正确的是( )
| A.金属元素与非金属元素能形成共价化合物 |
| B.只有在原子中,质子数才与核外电子数相等 |
| C.目前使用的元素周期表中,最长的周期含有36种元素 |
| D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2和8 |
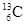 -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。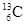 表示的碳原子
表示的碳原子
| A.核外有13个电子,其中4个能参与成键 |
| B.核内有6个质子,核外有7个电子 |
| C.质量数为13,原子序数为6,核内有7个质子 |
| D.质量数为13,原子序数为6,核内有7个中子 |
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1:1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是__________________(用元素符号表示),下列表述中能证明这一事实的是_________________(填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式___________,并写出该化合物与水反应的离子方程式______;
(4)元素T和氢元素以原子个数比1∶1化合形成的化合物属于______________,元素Z与元素T形成的化合物属于____________________(以上两空选填“共价化合物”或“离子化合物”)。