题目内容
(1)下列方法可以证明2HI(g)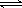 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化
(2)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)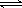 2SO3(g)。研究发现,
2SO3(g)。研究发现,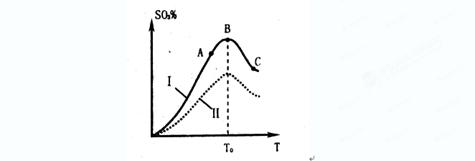
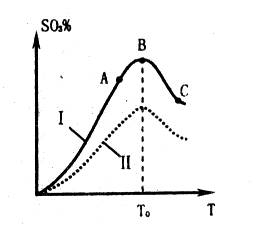
SO3的体积分数(SO3%)随温度(T)的变化如上图所示:
下列判断正确的是
A. 该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:VA>VC
C. 反应达到B点时,2V正(O2)=V逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则II是Fe2O3作催化剂的曲线
(1)②④⑤ (2)AC
解析试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以④⑤正确。①中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不正确。②中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。速率之比是相应的化学计量数之比,因此③中的关系始终是成立,不正确。反应前后气体的体积不变,因此气体的总物质的量、体积和压强始终是不变的,⑥不能说明。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,⑦不正确,因此答案选②④⑤。
(2)根据图像可知,当三氧化硫的含量达到最大值时,反应达到平衡状态。继续升高温度,含量反而降低,这说明正方应时放热反应,升高温度平衡向逆反应方向进行,A、C正确;C点温度高于A点温度,所以C点反应速率大于A点反应速率,B不正确;催化剂不能改变平衡状态,则平衡时三氧化硫的含量是不变的,D不正确,答案选AC。
考点:考查可逆反应平衡状态的判断以及外界条件对平衡状态的影响
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。

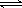 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是 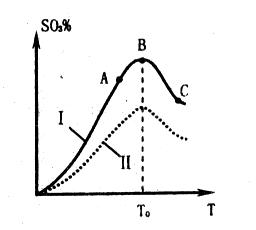
 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是 
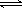 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是