题目内容
Mg、Zn、Al三种金属的混合物与足量的稀硫酸反应,生成2.8升氢气(S·T·P),原三种金属的物质的量之和可能是( )
| A.0.125 mol | B.0.10 mol | C.0.08 mol | D.0.20 mol |
B
标准状况下为2.8L气体的物质的量为2.8L/22.4L·mol-1=0.125mol,
金属Mg、Zn与硫酸反应都表现为+2价,Al为+3价,利用电子转移守恒计算三种金属的物质量之和,
故有2n(Mg)+2n(Zn)+3n(Al)=2n(H2),
即n(Mg)+n(Zn)+1.5n(Al)=n(H2)=0.125mol,
0.125mol =n(Mg)+n(Zn)+1.5n(Al)> n(Mg)+n(Zn)+n(Al)
如全是Al,则金属最小为:0.125mol×2/3=0.0833mol,
故选B.

练习册系列答案
相关题目
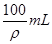
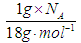
 入足量的NaOH溶液中,转移的电子数为0.5NA
入足量的NaOH溶液中,转移的电子数为0.5NA