题目内容
已知H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1.下列说法中不正确的是( )
| 1 |
| 2 |
| A、1mol H2完全燃烧生成液态水放出的热量大于241.8kJ |
| B、2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1 |
| C、H2的燃烧热为241.8 kJ?mol-1 |
| D、断开1mol H2O(g)的化学键吸收的总能量大于断裂1mol H2和0.5mol O2的化学键所吸收的总能量 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、水蒸气变成液态水要放出热量;
B、已知H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/mol,△H与方程式的化学计量数对应;
C、燃烧热是指生成液态水时放出的热量;
D、△H=反应物键能和-生成物键能和.
B、已知H2(g)+
| 1 |
| 2 |
C、燃烧热是指生成液态水时放出的热量;
D、△H=反应物键能和-生成物键能和.
解答:
解:A、水蒸气变成液态水要放出热量,故A正确;
B、已知H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/mol,则2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,故B正确;
C、氢气燃烧热大于241.8KJ/mol,故C错误;
D、△H<0,说明生成物的键能和大于反应物键能和,故D正确.
故选:C.
B、已知H2(g)+
| 1 |
| 2 |
C、氢气燃烧热大于241.8KJ/mol,故C错误;
D、△H<0,说明生成物的键能和大于反应物键能和,故D正确.
故选:C.
点评:本题考查热化学方程式中的焓变与化学计量数的对应、焓变与键能的关系、燃烧热的求算,注意△H与化学计量数必须对应起来.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
下列物质中,含有离子键的是( )
| A、Cl2 |
| B、CO2 |
| C、NaCl |
| D、H2O2 |
2013年2月15日早晨一块陨石坠落在俄罗斯乌拉尔山脉地区,引发爆炸,造成1000余人受伤,专家化验陨石碎片含铁10%.下列有关铁及其化合物的叙述正确的是( )
| A、1mol Fe分别与足量的盐酸或氯气反应电子转移数相等 |
| B、水蒸气与铁在常温下反应生成Fe3O4和H2 |
| C、Fe2O3和Al2O3都能溶解于NaOH溶液中 |
| D、生铁中的含碳量高于钢中含碳量 |
如图是两个氢原子相互接近时的能量变化图,则有关该图的说法正确的是( )
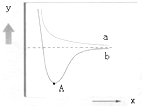

| A、y代表两原子之间的核间距 |
| B、x代表体系具有的能量 |
| C、a代表核外电子自旋相反的两个氢原子能量变化 |
| D、A点时表示两原子间形成了稳定的共价键 |
下列有机物的命名正确的是( )
| A、2-乙基丁烷 |
| B、2,2-二甲基丁烷 |
| C、3,3-二甲基丁烷 |
| D、2,3,3一三甲基丁烷 |
下列离子方程式书写正确的是( )
| A、硫酸氢钠溶液和过量的Ba(OH)2溶液反应:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
| B、氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O |
| C、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ |
| D、将1mol?L-1的NaAlO2溶液和2.5mol?L-1的HCl溶液等体积均匀混合:AlO2-+H++H2O═Al(OH)3↓ |
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
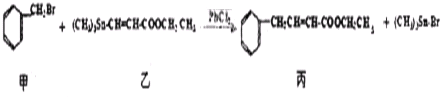
下列分析判断正确的是( )

下列分析判断正确的是( )
| A、分离提纯有机物丙宜在NaOH热溶液中进行 |
| B、利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
| C、可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 |
| D、PbCl2的作用是提高反应物的活性,加快反应速率 |
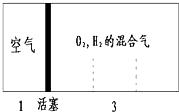 如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )