题目内容
Ⅰ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的价电子(外围电子)排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2 CH2、②HC≡CH、③
CH2、②HC≡CH、③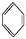 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
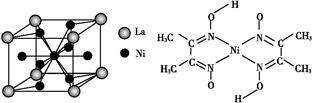
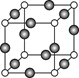
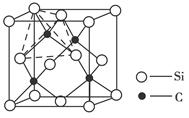
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。
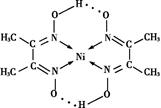
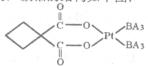
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
(1)基态镍原子的价电子(外围电子)排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2
 CH2、②HC≡CH、③
CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。 (4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。

(1)3d84s2
(2)N2 CN-(或O22—、C22—、NO-)
(3)①③④ 平面三角
(4)>
(5)LaNi5或Ni5La
(6)见图
(2)N2 CN-(或O22—、C22—、NO-)
(3)①③④ 平面三角
(4)>
(5)LaNi5或Ni5La
(6)见图

(1)根据构造原理可知,基态镍原子的价电子(外围电子)排布式为3d84s2。
(2)价电子数与原子数分别都相等的是等电子体,因此与CO互为等电子体的一种分子和一种离子的化学式分别是N2和CN-。
(3)乙烯、苯、甲醛都是平面形结构,因此碳原子都是sp2杂化。乙炔是直线形结构,所以碳原子是sp杂化,因此答案选①③④。甲醛分子中中心碳原子没有孤对电子,因此甲醛是平面三角形结构。
(4)NiO与FeO形成的晶体都是离子晶体,构成离子晶体的离子半径越小,电荷数越多,离子键越强,晶格能越大,熔点就越高,所以NiO的熔点大于FeO的熔点。
(5)根据晶胞的结构可知,镧原子的个数是8×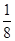 =1,Ni有4个位于面心,另4个在上下两个面上,1个位于体心,所以镍原子个数是4×
=1,Ni有4个位于面心,另4个在上下两个面上,1个位于体心,所以镍原子个数是4×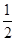 +4×
+4×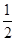 +1=5,所以化学式是LaNi5或Ni5La。
+1=5,所以化学式是LaNi5或Ni5La。
(6)根据结构图可知,氮原子是配体,镍原子提供空轨道。而氧原子与氢原子之间可以形成氢键,因此表示是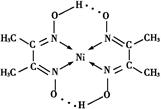
(2)价电子数与原子数分别都相等的是等电子体,因此与CO互为等电子体的一种分子和一种离子的化学式分别是N2和CN-。
(3)乙烯、苯、甲醛都是平面形结构,因此碳原子都是sp2杂化。乙炔是直线形结构,所以碳原子是sp杂化,因此答案选①③④。甲醛分子中中心碳原子没有孤对电子,因此甲醛是平面三角形结构。
(4)NiO与FeO形成的晶体都是离子晶体,构成离子晶体的离子半径越小,电荷数越多,离子键越强,晶格能越大,熔点就越高,所以NiO的熔点大于FeO的熔点。
(5)根据晶胞的结构可知,镧原子的个数是8×
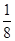 =1,Ni有4个位于面心,另4个在上下两个面上,1个位于体心,所以镍原子个数是4×
=1,Ni有4个位于面心,另4个在上下两个面上,1个位于体心,所以镍原子个数是4×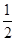 +4×
+4×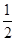 +1=5,所以化学式是LaNi5或Ni5La。
+1=5,所以化学式是LaNi5或Ni5La。(6)根据结构图可知,氮原子是配体,镍原子提供空轨道。而氧原子与氢原子之间可以形成氢键,因此表示是


练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 键
键 键
键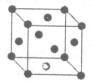

 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;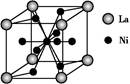
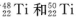 两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。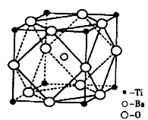
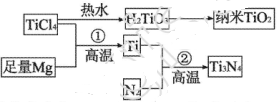 。
。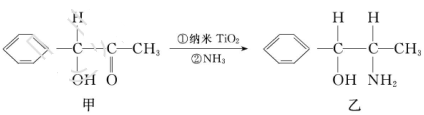
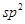 杂化的碳原子个数为_____,化合物乙中采取
杂化的碳原子个数为_____,化合物乙中采取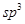 杂化的原子的第一电离能由大到小的顺序为_____。
杂化的原子的第一电离能由大到小的顺序为_____。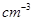 (NA为阿伏加德罗常数的数值,只列算式)。
(NA为阿伏加德罗常数的数值,只列算式)。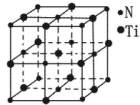
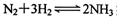 实现储氢和输氢。下列说法正确的是 ;
实现储氢和输氢。下列说法正确的是 ;