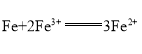题目内容
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
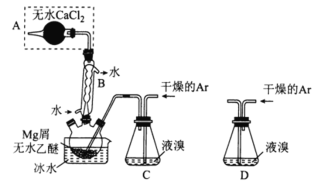
主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
⑴仪器A的名称是___________。B的作用为___________。
⑵下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
⑶若将装置C改为装置D,可能会导致的后果是___________。
⑷为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是_______________(用质量分数表示)。
【答案】干燥管 冷凝回流溴和乙醚 C 会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 滴入最后一滴EDTA标准液时,溶液颜色由酒红色变为纯蓝色,且30秒内不恢复原色 97.52%
【解析】
三颈烧瓶中加入镁屑和无水乙醚,向三颈烧瓶中缓缓吹入溴蒸汽,发生反应,反应剧烈,用球形冷凝管冷凝回流溴和乙醚,并用冰水浴冷却烧瓶,反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却,析出晶体,过滤得三乙醚合溴化镁粗品,用CCl4溶解粗品,冷却,析岀晶体,过滤,洗涤,再加热至160℃分解得无水MgBr2产品。
⑴根据图中仪器的特点,仪器A的名称是干燥管;Mg与Br2反应剧烈放热,而乙醚和溴易挥发,因此B的作用为冷凝回流溴和乙醚,原料充分反应;故答案为:干燥管;冷凝回流溴和乙醚。
⑵A. MgBr2具有强吸水性,75%的乙醇中有水,因此不能用75%的乙醇代替CCl4溶解粗品,A错误;
B. 加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,而不是为了除去CCl4,B错误;
C. 为了减少晶体的损失,洗涤晶体可选用0℃的CCl4,C正确;
D. 该步骤除去了可能残留的溴和乙醚,D错误;
故答案为:C。
⑶镁和溴单质反应剧烈放热,选用D装置会使液溴快速压入到三颈烧瓶中,反应过快,放出大量的热,存在安全隐患;故答案为:会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患。
⑷①根据滴定原理,用EDTA标液滴定溴化镁,以铬黑T(简写为In)为指示剂,则指示剂与镁离子形成酒红色MgIn-,当EDTA与镁离子反应完全,溶液显示出铬黑T的纯蓝色;故答案为:滴入最后一滴EDTA标准液时,溶液颜色由酒红色变为纯蓝色,且30秒内不恢复原色。
②根据Mg2++Y4 = MgY2,n(MgBr2)=n(Mg2+)=0.0500 molL1×26.50×103L=1.325×103mol,因此测得无水MgBr2产品的纯度是![]() ;故答案为:97.52%。
;故答案为:97.52%。