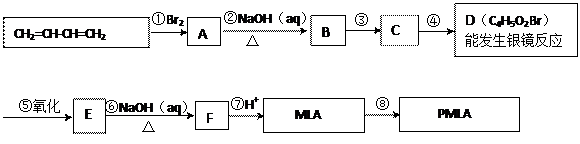题目内容
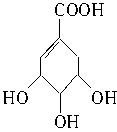
三聚氰酸【C3N3(OH)3】可用于消除汽车尾气中的氮氧化物(以NO2计),其原理可表示为:当加热至一定温度时,C3N3(OH)3发生分解生成异氰酸:C3N3(OH)3→3HNCO(已知异氰酸中碳元素呈+4价),产生的HNCO能和NO2反应生成N2、CO2和H2O。
 (1)在消除NO2的反应中,发生氧化反应的过程是 → (请标明有关元素的化合价变化)。
(1)在消除NO2的反应中,发生氧化反应的过程是 → (请标明有关元素的化合价变化)。
 (2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:
(2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:

 (3)按上述反应式进行反应,计算吸收1.0kgNO2气体,消耗三聚氰酸的质量为 kg。
(3)按上述反应式进行反应,计算吸收1.0kgNO2气体,消耗三聚氰酸的质量为 kg。
 (4)常温下,用注射器吸入20mL NO2气体,用橡皮塞将针孔封闭,把注射器的活塞迅速向外拉至50mL处停止,观察到的现象是: 。
(4)常温下,用注射器吸入20mL NO2气体,用橡皮塞将针孔封闭,把注射器的活塞迅速向外拉至50mL处停止,观察到的现象是: 。
 (1)在消除NO2的反应中,发生氧化反应的过程是 → (请标明有关元素的化合价变化)。
(1)在消除NO2的反应中,发生氧化反应的过程是 → (请标明有关元素的化合价变化)。 (2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:
(2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:

 (3)按上述反应式进行反应,计算吸收1.0kgNO2气体,消耗三聚氰酸的质量为 kg。
(3)按上述反应式进行反应,计算吸收1.0kgNO2气体,消耗三聚氰酸的质量为 kg。 (4)常温下,用注射器吸入20mL NO2气体,用橡皮塞将针孔封闭,把注射器的活塞迅速向外拉至50mL处停止,观察到的现象是: 。
(4)常温下,用注射器吸入20mL NO2气体,用橡皮塞将针孔封闭,把注射器的活塞迅速向外拉至50mL处停止,观察到的现象是: 。 -3 0
-3 0 (1)HNCO N2(同时填写CO2和H2O也正确,化合价1分,化学式正确1分)2分
(1)HNCO N2(同时填写CO2和H2O也正确,化合价1分,化学式正确1分)2分  (2) 2分
(2) 2分


 (3)1.2 2分
(3)1.2 2分 (4)红棕色气体先变浅,后变深 2分
(4)红棕色气体先变浅,后变深 2分本题考查氧化还原反应。HNCO中碳元素呈+4价,氮元素为-3价,与NO2反应生成N2、CO2和H2O,碳元素化合价未变,氮元素发生归中反应,方程式为
 HNCO + NO2 → N2+CO2+H2O
HNCO + NO2 → N2+CO2+H2O ↑3e-×4 ×2 ↓4e-×3×2
↑3e-×4 ×2 ↓4e-×3×2 配平方程式:8HNCO +6NO2 ="=" 7N2+8CO2+4H2O,根据方程式进行计算,1.0kg÷46×8/6×43=1.2Kg。NO2气体中存在平衡2NO2
配平方程式:8HNCO +6NO2 ="=" 7N2+8CO2+4H2O,根据方程式进行计算,1.0kg÷46×8/6×43=1.2Kg。NO2气体中存在平衡2NO2 N2O4,减压瞬间颜色变浅,平衡逆向移动,颜色又会加深一点。
N2O4,减压瞬间颜色变浅,平衡逆向移动,颜色又会加深一点。
练习册系列答案
相关题目