题目内容
(1)25℃、101kPa时,
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液的c(OH-)为
1mol
1mol
纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液的c(OH-)为
2.0×10-7
2.0×10-7
mol/L.分析:(1)根据燃烧热的概念分析;
(2)纯水中的c(H+)=c(OH-).
(2)纯水中的c(H+)=c(OH-).
解答:解:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,故答案为:1mol;
(2)纯水中的c(H+)=c(OH-),已知某温度下,纯水中的c(H+)=2.0×10-7mol/L,所以溶液的c(OH-)为2.0×10-7mol/L,故答案为:2.0×10-7.
(2)纯水中的c(H+)=c(OH-),已知某温度下,纯水中的c(H+)=2.0×10-7mol/L,所以溶液的c(OH-)为2.0×10-7mol/L,故答案为:2.0×10-7.
点评:本题考查了燃烧热的概念,纯水中c(H+)与c(OH-)的关系,难度不大.

练习册系列答案
相关题目
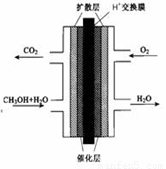
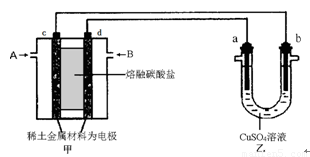
 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 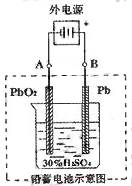
 Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。