题目内容
一位同学欲配制6 mol·L-1的H2SO4溶液。他找来了三种不同浓度的硫酸:①240 mL 1 m ol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的浓硫酸。另外,他找来了三种规格的容量瓶:250 mL容量瓶;500 mL容量瓶;1 000 mL容量瓶。这位同学希望将①②两种硫酸全部用完,不足部分再由③补充。请通过计算,帮助这位同学确定选用哪种规格的容量瓶,以及需要浓硫酸的体积是多少。
ol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的浓硫酸。另外,他找来了三种规格的容量瓶:250 mL容量瓶;500 mL容量瓶;1 000 mL容量瓶。这位同学希望将①②两种硫酸全部用完,不足部分再由③补充。请通过计算,帮助这位同学确定选用哪种规格的容量瓶,以及需要浓硫酸的体积是多少。
【答案】 用1 000 mL容量瓶,需要295 mL浓硫酸。
【解析】 由找来的三种规格的容量瓶决定了所配制的6 mol·L-1的硫酸的体积只能在250 mL、500 mL、1 000 mL中选择,因此,首先必须通过试探确定出配制的6 mol·L-1的硫酸的体积是多少。
150 mL 25% H2SO4溶液的物质的量浓度:
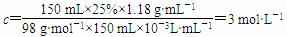
确定配制6 mol·L-1H2SO4溶液的体积:
因为①②两种硫酸体积和为240 mL+150 mL=390 mL,而它 们的浓度又都小于6 mol·L-1,所以不能选用250 mL的容量瓶。
们的浓度又都小于6 mol·L-1,所以不能选用250 mL的容量瓶。
设配制500 mL溶液,并设所需浓硫酸的体积为x。
0.5 L×6 mol·L-1=0.24 L×1 mol·L-1+0.15 L×3 mol·L-1+x×18 mol·L-1
x=0.128 3L=128.3 mL
因为128.3 mL+240 mL+150 mL=518.3 mL>500 mL,所以500 mL的容量瓶也不能选用。
设配制1 000 mL,并设需浓硫酸的体积为y。
1 L×6 mol·L-1=0.24 L×1 mol·L-1+0.15 L×3 mol·L-1+y×18 mol·L-1
y=0.295 L=295 mL
因为295 mL+240 mL+150 mL=685 mL<1 000 mL,所以可以选用1 000 mL的容量瓶。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案