题目内容
8.下列热化学方程式中,正确的是( )| A. | 甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃,300MPa}^{催化剂}$2NH3(g)△H=-38.6kJ/mol | |
| C. | NaOH(s)+$\frac{1}{2}$ H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol | |
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ/moL |
分析 A、燃烧热指在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.单位为kJ/mol,生成的水应为液态.
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反;
C、中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量;
D、可计算1molC2H2完全燃烧生成液态水和二氧化碳气体放出的热量,写出热化学方程式;
解答 解:A、甲烷的标准燃烧热为-890.3kJ•mol-1,表示1mol甲烷完全燃烧生成二氧化碳与液态水放出热量为890.3kJ,甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ•mol-1,故A错误;
B、相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,故B错误;
C、浓硫酸溶解放热,焓变为负值,NaOH(s)+$\frac{1}{2}$ H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H<-57.3kJ/mol,故C错误;
D、2.00g的C2H2的物质的量为$\frac{2g}{26g/mol}$=0.077mol,释放热量99.6kJ,则C2H2的燃烧热为$\frac{99.6KJ}{0.077mol}$=1294.8 kJ/mol,可写出热化学方程式:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2589.6kJ/mol,故D正确;
故选D.
点评 本题考查反应热、离子方程式、可逆反应,难度中等,注意燃烧热、中和热概念的理解应用,掌握基础是关键.


| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 黑火药爆炸 | D. | 用焦炭制水煤气 |
| A. | 42 | B. | 82 | C. | 162 | D. | 84 |
| A. | HNO3 | B. | 盐酸 | C. | KOH溶液 | D. | 通入CO2气体 |
| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ•mol-1 | |
| B. | 已知C(石墨)→C(金刚石)△H=+119kJ•mol-1,则相同条件下等质量的石墨、金刚石分别完全燃烧,石墨放出的能量比金刚石的高 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3kJ | |
| D. | 已知25℃、101 kPa条件下:4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9 kJ/mol;4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1kJ/mol,等质量的O2比O3能量低,由O2变O3为放热反应 |
(1).已知N2(g)+O2(g)=2NO(g)△H=+180.5KJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ•mol-1
则加催化剂处理汽车尾气的热化学方程是2CO(g)+2NO(g)=2CO2(g)+N2(g)△H=-746.5KJ•mol-1
(2).反应2NO2(g)?2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) | 0 | 10 | 20 | 25 | 30 |
| 条件A[n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
| 条件B[n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是ACE
A.V正(NO2)=V逆(NO)
B.c(NO2)=c(NO)
C.O2的物质的量不变
D.混合气体的密度不变
E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为0.0015mol•L-1•s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应正向(填“正向”、“逆向”或“不移动”).
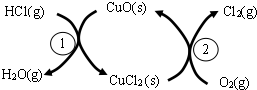 (1)盖斯定律在生产和科学研究中有很重要的意义.
(1)盖斯定律在生产和科学研究中有很重要的意义.