题目内容
【题目】含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n:m可能( )
①5:1、②9:2、③3:1、④2:1、⑤4:1
A. ②③ B. ①③④ C. ②③⑤ D. ①③
【答案】C
【解析】含n克HNO3的稀溶液恰好与m克Fe完全反应,生成硝酸铁时,发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,溶解Fe的质量最小,根据电子转移守恒n(NO)= ![]() ×
×![]() =
=![]() mol,根据氮原子守恒可知n(HNO3)=n(NO)+3n[Fe(NO3)3],即
mol,根据氮原子守恒可知n(HNO3)=n(NO)+3n[Fe(NO3)3],即![]() mol+
mol+![]() mol×3=
mol×3=![]() ,整理得2n=9m,生成硝酸亚铁时溶解Fe的质量最大,根据电子转移守恒n(NO)=
,整理得2n=9m,生成硝酸亚铁时溶解Fe的质量最大,根据电子转移守恒n(NO)= ![]() ×
×![]() =
=![]() mol,根据氮原子守恒可知n(HNO3)=n(NO)+2n[Fe(NO3)2],则
mol,根据氮原子守恒可知n(HNO3)=n(NO)+2n[Fe(NO3)2],则![]() mol+2×
mol+2×![]() mol=
mol=![]() ,整理得n=3m,故m的取值范围为:
,整理得n=3m,故m的取值范围为: ![]() n≤m≤
n≤m≤![]() n,②③⑤都符合,故选C。
n,②③⑤都符合,故选C。

【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______________、_________________。
实验用品 | 溶液温度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | _______ |
② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ | |
(2)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ·℃-1·kg-1,各物质的密度均为lg·cm-3。计算完成上表。△H=____________
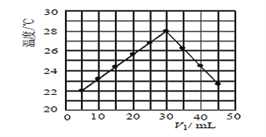
(3)某研究小组将V1mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2 =50mL)。此反应所用NaOH溶液的浓度应为__________mol/L。