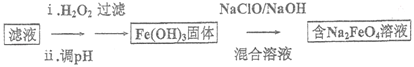
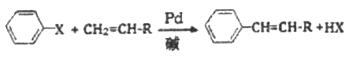
题目内容
【题目】100mL 0.1mol/L AlCl3溶液中,加入1mol/L NaOH溶液v mL后,再滴加1mol/L盐酸。滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如图示的关系,则加NaOH溶液的体积为( )
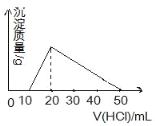
A. 10mL B. 30mL C. 40mL D. 50mL
【答案】D
【解析】
50mLAlCl3的物质的量是n=cV=0.1×0.1=0.01mol,Al(OH)3消耗盐酸的体积是50-20=30mL,盐酸物质的量是n=cV=1×0.03=0.03mol,根据反应AlOH)3+3HCl=AlCl3+3H2O可知, 设Al(OH)3的量为x,3x =0.03mol,x=0.01mol,所以Al3+是全部沉淀的;
①AlCl3与氢氧化钠溶液反应生成偏铝酸钠,反应为:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,因此n(NaOH)=4n(AlCl3)= 0.01×4=0.04mol;
②NaOH消耗HCl的体积是10mL=0.01L,反应为HCl+NaOH=NaCl+H2O,因此n(NaOH)= n(HCl)= 0.01×1=0.01mol;
所以消耗NaOH总的物质的量是0.04+0.01=0.05mol,体积是V=n/c=0.05/1=0.05L=50mL,D正确;
正确答案:D。

【题目】如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A. AB. BC. CD. D
【题目】在高温下,Fe 与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe 与水蒸气反应的实验"。请回答该实验中的问题。

(1)写出该反应的化学方程式__________。
(2)实验前必须对整套装置进行的操作是___________;
(3)在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①实验中使用肥皂液的作用是_____________________________。
②甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验。
实验 编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质是__________________________;不能确定是否存在FeO的原因是____________________________________。
③如果黑色粉末是Fe3O4,则黑色粉末和盐酸反应得离子方程式为________________。