题目内容
在一定温度下,10L密闭容器中加入0.05molSO2、0.03molO2,经10min后反应达平衡,测得C(SO3)=0.004mol/L试求:
(1)SO2的转化率为多少?
(2)用SO2表示该反应的反应速率为多少?
(3)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(4)平衡时体系中SO3的百分含量(体积分数)为多少?
(5)平衡常数K为多少?
(1)SO2的转化率为多少?
(2)用SO2表示该反应的反应速率为多少?
(3)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(4)平衡时体系中SO3的百分含量(体积分数)为多少?
(5)平衡常数K为多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算得到平衡时各成分的浓度,进而求得转化率、反应速率,利用物质的量之比等于压强之比也等于浓度之比计算,以及体积之比等于物质的量之比也等于浓度之比,和平衡常数等于生成物平衡浓度的幂次方乘积除以反应物的平衡浓度幂次方乘积计算平衡常数.
解答:
解:在一定温度下,10L密闭容器中加入0.05molSO2、0.03molO2,经10min后反应达平衡时测得C(SO3)=0.004mol/L,依据平衡三段式得到:
2SO2 +O2 2SO3
2SO3
起始量(mol/L) 0.005 0.003 0
变化量(mol/L) 0.004 0.002 0.004
平衡量(mol/L) 0.001 0.001 0.004
(1)SO2的转化率为
×100%=80%,答:SO2的转化率为80%;
(2)用SO2表示该反应的反应速率为
=0.0004mol/(L?min),答:用SO2表示该反应的反应速率为0.0004mol/(L?min);
(3)平衡时容器内气体压强与反应前的压强之比为
=3:4,答:平衡时容器内气体压强与反应前的压强之比为3:4;
(4)平衡时体系中SO3的百分含量(体积分数)为
×100%=66.67%,答:平衡时体系中SO3的百分含量(体积分数)为66.67%;
(5)平衡常数K=
=
=1.6×104,答:平衡常数K为1.6×104;
2SO2 +O2
 2SO3
2SO3起始量(mol/L) 0.005 0.003 0
变化量(mol/L) 0.004 0.002 0.004
平衡量(mol/L) 0.001 0.001 0.004
(1)SO2的转化率为
| 0.004 |
| 0.005 |
(2)用SO2表示该反应的反应速率为
| 0.004 mol/L |
| 10min |
(3)平衡时容器内气体压强与反应前的压强之比为
| 0.001+ 0.001+0.004 |
| 0.005+ 0.003 |
(4)平衡时体系中SO3的百分含量(体积分数)为
| 0.004 |
| 0.001+0.001+0.004 |
(5)平衡常数K=
| c2(SO3) |
| c2(SO2)×c(O2) |
| 0.004 2 |
| 0.0012×0.001 |
点评:本题考查化学平衡三段式计算应用,转化率和平衡常数的概念理解,掌握基础是解题关键,题目较简单.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
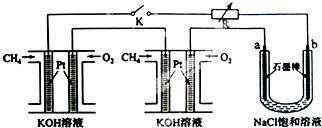
已知酸性强弱顺序为  ,下列化学方程式正确的是( )
,下列化学方程式正确的是( )
 ,下列化学方程式正确的是( )
,下列化学方程式正确的是( )A、 |
B、 |
C、 |
D、 |
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |
室温下,下列各组粒子在指定溶液中一定能大量共存的是( )
| A、pH=0的溶液中:K+、ClO-、CH3CHO、SO42- |
| B、Ba(OH)2溶液中:K+、AlO2-、NO3-、Na+ |
| C、加人KSCN显血红色的溶液中:I-、NO3-、SO42-、Fe2+ |
| D、常温下由水电离出的C(H+)=10-10mol?L-1的溶液:Na+、Mg2+、SO42-、Cl- |