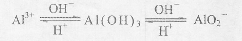题目内容
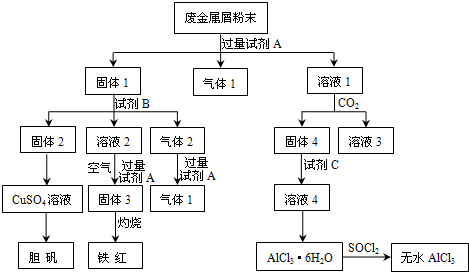
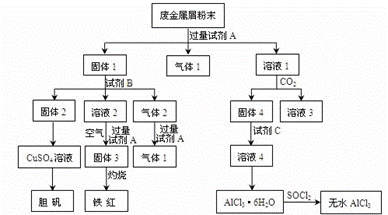
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: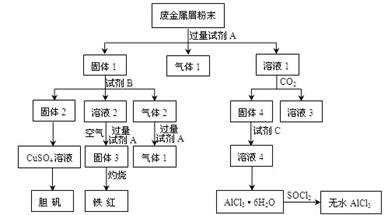
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是 。
(2)溶液2中含有的金属阳离子是 ;气体2的成分是 。
(3)溶液2转化为固体3的反应的离子方程式是 。
(4)固体2制取CuSO4溶液有多种。 如在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是 。
(5)溶液1转化为溶液4的一系列过程,不能简化为“向溶液1中+加试剂C→溶液4”,理由是 。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是 。
(1)2Al+2OH-+2H2O=AlO2-+3H2↑(1分) (2)Fe2+ (2分) CO2和H2(2分)
(3)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓(2分) (4)2Cu+4H++O2=Cu2++2H2O(1分)
(5)若溶液4中将混有试剂A中的阳离子(如Na+等),而使AlCl3溶液不纯净(2分)
(6)AlCl3·6H2O +6SOCl2 =AlCl3+12HCl+6SO2↑(2分)
解析试题分析:(1)根据转化图可知,固体1最终生成胆矾和铁红,这说明固体1中含有铁和铜两种元素。所以试剂A应该是氢氧化钠溶液,则生成的气体应该是铝和氢氧化钠反应生成的氢气,反应的离子方程式是2Al+2OH-+2H2O=AlO2-+3H2↑。
(2)固体2最终得到胆矾,这说明固体2是铜,则试剂B不应该是碱液。根据气体2和氢氧化钠溶液反应又有气体1产生,这说明试剂B应该是硫酸,气体2中含有CO2和氢气,而溶液2中含有亚铁离子。
(3)固体3是氢氧化铁,则溶液2转化为固体3的反应的离子方程式是4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。
(4)铜和稀硫酸不反应,但氧气能氧化单质铜生成氧化铜,进而生成硫酸铜,反应的方程式是2Cu+4H++O2=Cu2++2H2O。
(5)溶液1中含有偏铝酸钠,试剂C是盐酸。如果向溶液1中+加试剂C→溶液4”,则溶液4中将混有试剂A中的阳离子(如Na+等),而使AlCl3溶液不纯净。
(6)氯化铝水解,所以直接加热得不到氯化铝,需要在氯化氢的气氛中加热。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体,所以根据原子守恒可知,该气体应该是二氧化氯,则反应的方程式是AlCl3·6H2O +6SOCl2=AlCl3+12HCl+6SO2↑。
考点:考查以废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的流程图的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。