题目内容
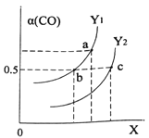
【题目】将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是
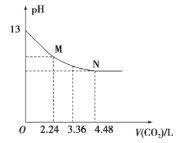
A. NaOH溶液的物质的量浓度为0.1 mol/L,体积为1 L
B. M、N点离子浓度的都是c(HCO3-)>c(CO32 -)
C. 曲线上任意点都符合:c(Na+)+c(H+)=c(CO32 -)+c(HCO3-)+c(OH-)
D. V=3.36 L时,溶液中的离子浓度关系是:c(Na+)>c(HCO3- )>c(CO32 -)>c(OH-)>c(H+)
【答案】D
【解析】
标准状况下4.48L二氧化碳的物质的量为0.2mol,2.24L二氧化碳的物质的量为0.1mol。据图可知,当通入0.2mol二氧化碳时,氢氧化钠与二氧化碳恰好反应生成NaHCO3,根据碳原子守恒,生成碳酸氢钠的物质的量为0.2mol,说明NaOH的物质的量也为0.2mol。
A.据图可知,没有通入二氧化碳之前,溶液的pH=13,则溶液中氢氧化钠的浓度为0.1mol/L,因为氢氧化钠的物质的量为0.2mol,则氢氧化钠溶液的体积为2L,故A错误;
B.M点时溶质为碳酸钠,溶液中离子浓度关系为:c(HCO3-)<c(CO32-),N点时溶质为碳酸氢钠,溶液中c(HCO3-)>c(CO32-),故B错误;
C.碳酸根离子带有2个单位的负电荷,碳酸根离子的系数应该为2,则溶液中的电荷守恒为:![]() ,故C错误;
,故C错误;
D.V=3.36L时,恰好生成0.05mol碳酸钠、0.1mol碳酸氢钠,CO32-的水解程度大于HCO3-的水解程度,则c(HCO3-)>c(CO32-),水解使溶液显碱性,则c(OH-)>c(H+),所以溶液中各离子浓度为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故D正确,答案选D。

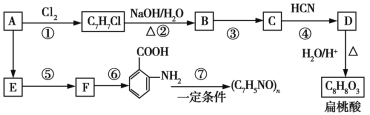
【题目】某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下(部分产物、合成路线、反应条件已略去):
已知:
Ⅰ.R—CHO+HCN![]()
![]()
Ⅱ.R—CN![]() R—COOH
R—COOH
Ⅲ.![]()
![]()
![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)C的分子式为__________。
(2)下列对相关反应类型的判断合理的是__________ (填序号)。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 加成 | 氧化 | 还原 | 缩聚 | |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:______________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有__________种,写出其中一种的结构简式:__________________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为____________________。
②写出反应Ⅴ的化学方程式:______________________________。