题目内容
一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2
g。原混合气体中CO2的质量为( )
A.12.5 g B.13.2 g C.19.7 g D.24.4 g
B
【解析】经过CaCl2被吸收的为水蒸气,即n(H2O)=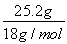 =1.4mol,根据CH4的组成可知,CO和CO2的物质的量之和为:
=1.4mol,根据CH4的组成可知,CO和CO2的物质的量之和为: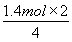 =0.7mol,设CO2的质量为x,则CO的质量为49.6 g-25.2 g-x,故有关系式:
=0.7mol,设CO2的质量为x,则CO的质量为49.6 g-25.2 g-x,故有关系式: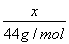 +
+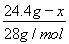 =0.7mol,解得:x=13.2 g。
=0.7mol,解得:x=13.2 g。

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
