题目内容
【题目】某学习小组的同学在实验室研究Na2CO3与NaHCO3的性质。
实验I:
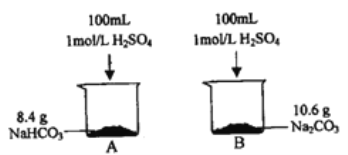
(1)产生气体的速率A___B(填“>”或“<”或“=”),结合化学用语说明原因_________。
(2)产生气体的体积A___B(填“>"或“<”或“=”),标准状况下,A烧杯中产生气体的体积为____L。
(3)任意写出一种将NaHCO3转变为Na2CO3的方法______________(用化学方程式表示)。
实验Ⅱ:1mL0.1mol/LNaHCO3溶液与lmL.0.01mol/LCa(OH)2溶液混合产生CaCO3白色沉淀。
(4)同学们设计了如下实验方案,验证上述反应过程,请将方案补充完整:
实验步骤
实验现象
i.取lmL0.1mol/LNaHCO3溶液。向其中加入1mL0.01mol/LCaCl2溶液
无明显现象
ⅱ.向上述溶液中滴加________
______________
【答案】 > Na2CO3与酸反应经历两步,而NaHCO3只有一步,因此A中产生气体速率快 = 2.24 2NaHCO3![]() Na2CO3+H2O+CO2↑等 Ca(OH)2 出现白色沉淀
Na2CO3+H2O+CO2↑等 Ca(OH)2 出现白色沉淀
【解析】(1)发生反应:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑,同等条件下,碳酸钠与硫酸反应速率不及碳酸氢钠与硫酸反应,所以A的反应程度更为剧烈,Na2CO3与酸反应经历两步:CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑,而NaHCO3只有一步,因此A中产生气体速率更快;(2)100mL1mol·L-1H2SO4溶液为0.1molH2SO4,分别和8.4g(0.1mol)NaHCO3、10.6g(0.1mol)Na2CO3反应,标准状况下,产生的CO2都为2.24L。(3)任意写出一种将NaHCO3转变为Na2CO3的方法:将NaHCO3加热转变为Na2CO3,2NaHCO3![]() Na2CO3+H2O+CO2↑等;(4)取lmL0.1mol/LNaHCO3溶液。向其中加入1mL 0.0 1mol/L CaCl2 溶液,无明显现象,再滴加 Ca(OH)2溶液,NaHCO3溶液与 Ca(OH)2溶液反应是分步进行的,过程为:HCO3-+OH-=CO32-+H2O Ca2++CO32-=CaCO3↓,向上述溶液中滴加Ca(OH)2溶液,开始就产生白色沉淀。
Na2CO3+H2O+CO2↑等;(4)取lmL0.1mol/LNaHCO3溶液。向其中加入1mL 0.0 1mol/L CaCl2 溶液,无明显现象,再滴加 Ca(OH)2溶液,NaHCO3溶液与 Ca(OH)2溶液反应是分步进行的,过程为:HCO3-+OH-=CO32-+H2O Ca2++CO32-=CaCO3↓,向上述溶液中滴加Ca(OH)2溶液,开始就产生白色沉淀。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】I.下图是中学化学常用的实验装置,诮回答下列问题

(1)用图I进行物质的分离提纯,该分离方法为________,若利用装置I分离酒精和水的混合物,还缺少的仪器__________;①的名称是__________,②的进水口是________(填“f" 或“g”)。
(2)现需配制500mL、0.1mol/LKCl 溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误之处: ①_________;②____________。
(3)仪器①~④中,使用时必须检查是否漏水的是_________(填序号)。
Ⅱ.分离和提纯物质的方法不仅用于实验研究而且广泛应用于工业生产和生活实际。
(4)海水晒盐过程中,通过蒸发的方法可得到粗盐固体;再将粗盐固体溶解后,再用过滤的方法除去其中的泥沙。粗盐中除泥沙外还含有可溶性杂质(如下表所示),可按下表所示由上至下的顺序依次除去(将表格填写完整)。
杂质 | 加入试剂的化学式 | 发生反应的离子方程式 |
硫酸盐 | ___________ | ___________ |
MgCl2 | NaOH | ___________ |
CaCl2 | Na2CO3 | ___________ |
依次加入上述试剂后,完全反应后,再进行过滤,再加入适量的盐酸 可除去上述步骤引入的 杂质离子。
(5) 从海带中可提取碘单质。用萃取的方法可将碘单质从水溶液中提取出来,该方法利用了I2在不同溶剂中的_______性不同。