题目内容
某化学兴趣小组利用由Cu2O、Al2O3、Fe2O3、SiO2组成的混合物,模拟工业上提取铜的工艺,设计如下图所示的简单操作流程:
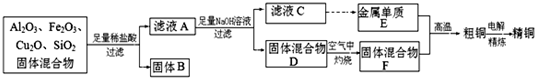
提示:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+.
(1)若固体B的成分为混合物,则其成分的化学式为______.此时,滤液A中铁元素的存在形式为______(填写离子符号),检验试剂是______.
(2)金属E与固体F发生的某一反应可用于焊接铁轨.则该反应的化学方程式为______.
(3)检验粗铜中含有金属E单质的试剂是______,典型现象是______,反应的离子方程式为______.
(4)利用电解法进行粗铜精炼时,下列叙述正确的是______.
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu-2e-═Cu2+
D.电解后,电解液中Cu2+浓度减小.
解:Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Ai和Fe的混合物,经过电解可的纯铜,
(1)由以上分析可知固体B的成分为SiO2和Cu,滤液A中铁元素的存在形式为Fe2+,检验时,可先加入KSCN溶液,溶液不变色,再滴加氯水,溶液变红色可证明,
故答案为:SiO2和Cu;Fe2+;KSCN溶液和新制氯水;
(2)E为Al,F为CuO和Fe2O3的混合物,发生2Al+Fe2O3 Al2O3+2Fe,可用于焊接铁轨,
Al2O3+2Fe,可用于焊接铁轨,
故答案为:2Al+Fe2O3 Al2O3+2Fe;
Al2O3+2Fe;
(3)可用NaOH溶液检验检验粗铜中含有金属Al,发生2Al+2OH-+2H2O=2AlO2-+3H2↑,现象是有气泡生成,
故答案为:NaOH溶液;有无色气泡冒出;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)A.电解时以粗铜作阳极,故A错误;
B.电解时阴极发生还原反应,阳极发生氧化反应,故B错误;
C.粗铜连接电源正极,纯铜连接电源负极,其电极反应是Cu-2e-═Cu2+,故C错误;
D.电解后,由于阳极为粗铜,溶液中含有Fe2+、Al3+,而阴极只生成Cu,则电解液中Cu2+浓度减小,故D正确.
故答案为:D.
分析:Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Ai和Fe的混合物,经过电解可的纯铜,以此解答该题.
点评:本题考查考查物质的制备以及分离和提纯等知识,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.
(1)由以上分析可知固体B的成分为SiO2和Cu,滤液A中铁元素的存在形式为Fe2+,检验时,可先加入KSCN溶液,溶液不变色,再滴加氯水,溶液变红色可证明,
故答案为:SiO2和Cu;Fe2+;KSCN溶液和新制氯水;
(2)E为Al,F为CuO和Fe2O3的混合物,发生2Al+Fe2O3
 Al2O3+2Fe,可用于焊接铁轨,
Al2O3+2Fe,可用于焊接铁轨,故答案为:2Al+Fe2O3
 Al2O3+2Fe;
Al2O3+2Fe;(3)可用NaOH溶液检验检验粗铜中含有金属Al,发生2Al+2OH-+2H2O=2AlO2-+3H2↑,现象是有气泡生成,
故答案为:NaOH溶液;有无色气泡冒出;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)A.电解时以粗铜作阳极,故A错误;
B.电解时阴极发生还原反应,阳极发生氧化反应,故B错误;
C.粗铜连接电源正极,纯铜连接电源负极,其电极反应是Cu-2e-═Cu2+,故C错误;
D.电解后,由于阳极为粗铜,溶液中含有Fe2+、Al3+,而阴极只生成Cu,则电解液中Cu2+浓度减小,故D正确.
故答案为:D.
分析:Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Ai和Fe的混合物,经过电解可的纯铜,以此解答该题.
点评:本题考查考查物质的制备以及分离和提纯等知识,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目