题目内容
铁是重要的常见金属材料,也是人类较早使用的金属之一,.请运用铁及其化合物的知识,完成下列问题.(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含
b.可能组成为
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
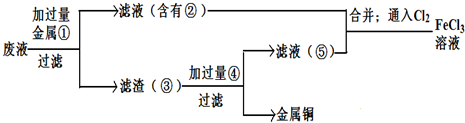
请写出上述实验中加入或生成的有关物质的化学式:
①
分析:(1)化合价升高元素失电子,化合价降低元素得电子,化合价升高值=化合价降低值=转移电子数,据此回答;
(2)根据胶体分散系的微粒直径大小范围是1~100nm来回答判断;
(3)铁离子具有氧化性,能和还原性的物质Cu之间发生反应;
(4)根据金属铜和三价铁离子之间的反应情况来假设溶液的组成情况.
(5)实验的目的是制取FeCl3溶液,借助金属铜和铁的性质差异来除去金属铜,用氯气将氯化亚铁氧化为铁离子,据此回答判断.
(2)根据胶体分散系的微粒直径大小范围是1~100nm来回答判断;
(3)铁离子具有氧化性,能和还原性的物质Cu之间发生反应;
(4)根据金属铜和三价铁离子之间的反应情况来假设溶液的组成情况.
(5)实验的目的是制取FeCl3溶液,借助金属铜和铁的性质差异来除去金属铜,用氯气将氯化亚铁氧化为铁离子,据此回答判断.
解答:解:(1)铝热反应中,Al元素化合价升高失电子,Fe元素化合价降低得电子,化合价升高值=化合价降低值=转移电子数=24,即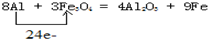 ,故答案为:
,故答案为: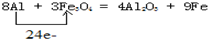 ;
;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,此时得到的分散系属于溶液,分散质微粒直径大小是<1nm,而胶体粒子粒径在1-100nm之间,故答案为:<1;胶体粒子粒径在1-100nm之间,该实验没有制备出胶体,因此粒径在此范围;
(3)铁离子具有氧化性,能和还原性的物质Cu之间发生反应:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)金属铜和三价铁离子之间的反应情况:当金属铜过量,得到的溶液中含有FeCl2、CuCl2;加入的金属铜少量,则剩余氯化铁,溶液的组成是FeCl3、FeCl2、CuCl2
,故答案为:a.FeCl2、CuCl2;b.FeCl3、FeCl2、CuCl2;
(5)①制取的是氯化铁溶液,金属①是铁;滤液②是氯化亚铁溶液;加入的铁过量,滤渣③是铁和铜;制取的是氯化铁,溶解铁,④加入应该是盐酸;
故答案为:Fe;Fe Cu;HCl.
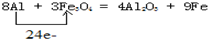 ,故答案为:
,故答案为: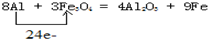 ;
;(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,此时得到的分散系属于溶液,分散质微粒直径大小是<1nm,而胶体粒子粒径在1-100nm之间,故答案为:<1;胶体粒子粒径在1-100nm之间,该实验没有制备出胶体,因此粒径在此范围;
(3)铁离子具有氧化性,能和还原性的物质Cu之间发生反应:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)金属铜和三价铁离子之间的反应情况:当金属铜过量,得到的溶液中含有FeCl2、CuCl2;加入的金属铜少量,则剩余氯化铁,溶液的组成是FeCl3、FeCl2、CuCl2
,故答案为:a.FeCl2、CuCl2;b.FeCl3、FeCl2、CuCl2;
(5)①制取的是氯化铁溶液,金属①是铁;滤液②是氯化亚铁溶液;加入的铁过量,滤渣③是铁和铜;制取的是氯化铁,溶解铁,④加入应该是盐酸;
故答案为:Fe;Fe Cu;HCl.
点评:本题涉及含铁元素的化合物的性质、胶体的制备、氧化还原反应中电子转移等知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目