题目内容
铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移__________________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是_________________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
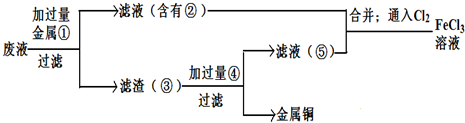
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:

请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________
(1)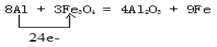
(2)<1 nm,胶体粒子粒径在1~100nm之间,该实验没有制备出胶体,因此粒径在此范围。
(3)2Fe3++ Cu=2Fe2+ +Cu2+。 (4)a . FeCl2、CuCl2 ;b. FeCl3 、FeCl2 、CuCl2
(5)① Fe ③ Fe、Cu ④ HCl
【解析】
试题分析:(1)铝是活泼的金属,能和四氧化生铁发生铝热反应生成铁和氧化铝。在反应中铝元素的化合价从0价升高到+3价,失去3个电子。四氧化生铁中铁元素的化合价从+ 价降低到0价,所以根据电子的得失守恒可知,其电子转移的表示方法为
价降低到0价,所以根据电子的得失守恒可知,其电子转移的表示方法为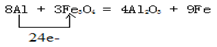 。
。
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,这说明反应中没有得到氢氧化铁胶体。由于胶体粒子粒径在1~100nm之间,该实验没有制备出胶体,所以此时分散系中粒子直径的范围是<1nm。
(3)铁离子具有氧化性,能把铜氧化生成铜离子,而铁离子被还原为亚铁离子,反应的离子方程式为2Fe3++ Cu=2Fe2+ +Cu2+。
(4)根据化学方程式2FeCl3+Cu=2FeCl2+CuCl2可知,反应后的溶液中溶质的可能组成是:a、如果恰好反应,则溶质是FeCl2、CuCl2;b、如果氯化铁过量,则溶质是FeCl3 、FeCl2 、CuCl2。
(5)铁的金属性强于铜,则要从溶液中中得到铜,需要加入金属铁置换出铜,即①是Fe,②是氯化亚铁;加入的铁是过量的,则得到的滤渣是铁和铜的混合物。要分离出铜,需要加入盐酸溶解铁,过滤、洗涤后得到铜,即④是盐酸,⑤是氯化亚铁和盐酸的混合物。将②与⑤混合通入氯气将氯化亚铁氧化生成氯化铁即可。
考点:考查氧化还原反应的表示;氢氧化铁胶体制备;离子方程式的书写以及物质的分离与提纯