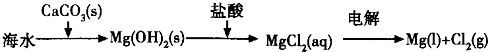
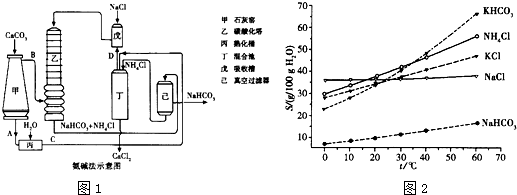
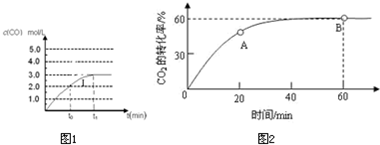
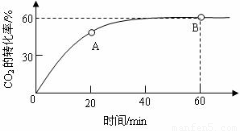
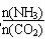题目内容
合成氨的原料气――H2,可以由天然气制取。其主要反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)
(1)1m3(标准状况下)CH4按上式完全反应,产生H2 的物质的量为_________mol。
(2)在某一条件下,CH4和O2的反应为2CH4(g)+O2(g)=2CO(g)+4H2(g)。
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V的范围(标准状况下)为__________。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体的组成如下表所示:
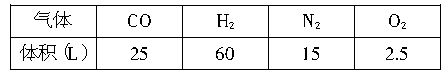
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)为__________。
(1)133.9
(2)3m3
(3)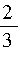
【试题分析】

练习册系列答案
相关题目