题目内容
8.比较是化学学习中的一种重要方法.下列各组比较中不正确的是( )| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象相同 |
分析 A.相同条件下,碳酸氢钠的溶解度小;
B.元素的非金属性越强,其氢化物越稳定;
C.元素的非金属性越强,其单质的氧化性越强;
D.盐酸滴加碳酸钠中,首先生成HCO3-,所以没有气泡,盐酸过量时,H+进一步与HCO3-反应生成CO2;碳酸钠滴到盐酸中直接反应生成氯化钠和二氧化碳.
解答 解:A.Na2CO3和NaHCO3在相同条件下,碳酸氢钠的溶解度小,则在水中的溶解度为:Na2CO3>NaHCO3,故A错误;
B.元素的非金属性越强,其氢化物越稳定,非金属性:F>Cl>Br>I,则热稳定性:HF>HCl>HBr>HI,故B正确;
C.元素的非金属性越强,其氢化物越稳定,非金属性:F>Cl>Br>I,则氧化性:F2>Cl2>Br2>I2,故C正确;
D.盐酸滴加碳酸钠中,首先生成HCO3-,所以没有气泡,盐酸过量时,H+进一步与HCO3-反应生成CO2;碳酸钠滴到盐酸中直接反应生成氯化钠和二氧化碳,所以二者现象不同,故D错误.
故选AD.
点评 本题考查碳酸钠和碳酸氢钠的性质、元素周期律,涉及溶解度、稳定性、与酸的反应、同主族元素性质的递变规律等,注意碳酸钠与酸反应时滴加顺序不同现象不同,题目难度不大.

练习册系列答案
相关题目
16. “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(1)═C2H5OH(1)△H=-44.2kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放热(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是cd.
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
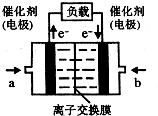
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+2H2O+4e-=4OH-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于5.6×10-5mo1/L.
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(1)═C2H5OH(1)△H=-44.2kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放热(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是cd.
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+2H2O+4e-=4OH-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于5.6×10-5mo1/L.
3.下列物质用途不正确的是( )
| A. | 溴化银可用于制胶片和有色玻璃 | B. | 过氧化钠可用于漂白织物、羽毛等 | ||
| C. | 碘化银可用于人工降雨 | D. | I2可以用于配制含碘食盐 |
 (写结构简式)
(写结构简式)
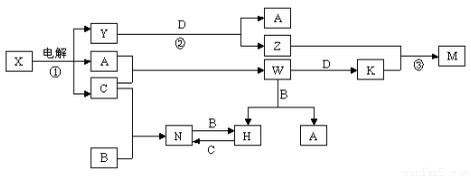
 、B、C、D是单质,其余是化合物。其中B、D是常见金属。又知A在C中点燃有苍白色火焰,M既可溶于盐酸又可溶于NaOH溶液。请回答下列问题:
、B、C、D是单质,其余是化合物。其中B、D是常见金属。又知A在C中点燃有苍白色火焰,M既可溶于盐酸又可溶于NaOH溶液。请回答下列问题: 。
。 3)写出下列反应的离子方程式:
3)写出下列反应的离子方程式: