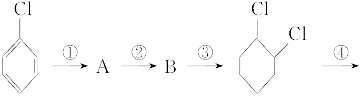
题目内容
某一氯代烷1.85 g,与足量的NaOH水溶液混合加热后,用硝酸酸化,再加入足量AgNO3溶液,生成白色沉淀2.87 g。
(1)通过计算,写出这种一氯代烷的各种同分异构体的结构简式。
(2)若此一氯代烷与足量NaOH溶液共热后,不经硝酸酸化就加AgNO3溶液,将会产生什么现象?写出有关化学反应方程式。
(3)能否用硝酸银溶液直接与卤代烷反应来鉴别卤代烷?为什么?
(1)通过计算,写出这种一氯代烷的各种同分异构体的结构简式。
(2)若此一氯代烷与足量NaOH溶液共热后,不经硝酸酸化就加AgNO3溶液,将会产生什么现象?写出有关化学反应方程式。
(3)能否用硝酸银溶液直接与卤代烷反应来鉴别卤代烷?为什么?
(1)同分异构体的可能结构有:
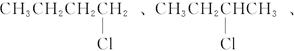
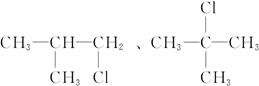
(2)若C4H9Cl与NaOH水溶液共热后不经硝酸酸化就加AgNO3溶液,将会产生褐色沉淀。因为过量的NaOH能与AgNO3反应,生成白色的AgOH沉淀,AgOH不稳定,立即分解为褐色Ag2O。有关的化学方程式为:
AgNO3+NaOH====AgOH↓+NaNO3
2AgOH====Ag2O+H2O
(3)不能用硝酸银溶液直接与卤代烃反应来鉴别卤代烃。因为卤代烃中的卤素均是以卤原子的形式与碳原子结合,不能在水溶液中直接电离出X-(F-、Cl-、Br-、I-),故不能与Ag+反应产生沉淀。
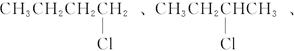
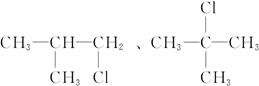
(2)若C4H9Cl与NaOH水溶液共热后不经硝酸酸化就加AgNO3溶液,将会产生褐色沉淀。因为过量的NaOH能与AgNO3反应,生成白色的AgOH沉淀,AgOH不稳定,立即分解为褐色Ag2O。有关的化学方程式为:
AgNO3+NaOH====AgOH↓+NaNO3
2AgOH====Ag2O+H2O
(3)不能用硝酸银溶液直接与卤代烃反应来鉴别卤代烃。因为卤代烃中的卤素均是以卤原子的形式与碳原子结合,不能在水溶液中直接电离出X-(F-、Cl-、Br-、I-),故不能与Ag+反应产生沉淀。
(1)一氯代烷的通式为CnH2n+1Cl,有关反应的方程式为:
CnH2n+1Cl+H2O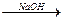 CnH2n+1OH+HCl
CnH2n+1OH+HCl
HCl+NaOH====NaCl+H2O
NaOH+HNO3====NaNO3+H2O
NaCl+AgNO3====AgCl↓+NaNO3
则1 mol CnH2n+1Cl相当于1 mol AgCl,即:
CnH2n+1Cl — AgCl
14n+36.5 143.5
1.85 g 2.87 g
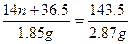 n=4
n=4
因此,一氯代烷的分子式为C4H9Cl,其同分异构体的可能结构有:
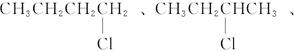
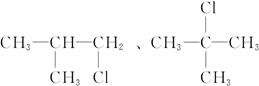
(2)若C4H9Cl与NaOH水溶液共热后不经硝酸酸化就加AgNO3溶液,将会产生褐色沉淀。因为过量的NaOH能与AgNO3反应,生成白色的AgOH沉淀,AgOH不稳定,立即分解为褐色Ag2O。有关的化学方程式为:
AgNO3+NaOH====AgOH↓+NaNO3
2AgOH====Ag2O+H2O
(3)不能用硝酸银溶液直接与卤代烃反应来鉴别卤代烃。因为卤代烃中的卤素均是以卤原子的形式与碳原子结合,不能在水溶液中直接电离出X-(F-、Cl-、Br-、I-),故不能与Ag+反应产生沉淀。
CnH2n+1Cl+H2O
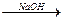 CnH2n+1OH+HCl
CnH2n+1OH+HClHCl+NaOH====NaCl+H2O
NaOH+HNO3====NaNO3+H2O
NaCl+AgNO3====AgCl↓+NaNO3
则1 mol CnH2n+1Cl相当于1 mol AgCl,即:
CnH2n+1Cl — AgCl
14n+36.5 143.5
1.85 g 2.87 g
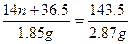 n=4
n=4因此,一氯代烷的分子式为C4H9Cl,其同分异构体的可能结构有:
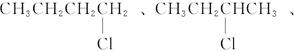
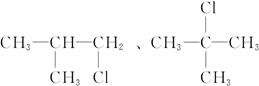
(2)若C4H9Cl与NaOH水溶液共热后不经硝酸酸化就加AgNO3溶液,将会产生褐色沉淀。因为过量的NaOH能与AgNO3反应,生成白色的AgOH沉淀,AgOH不稳定,立即分解为褐色Ag2O。有关的化学方程式为:
AgNO3+NaOH====AgOH↓+NaNO3
2AgOH====Ag2O+H2O
(3)不能用硝酸银溶液直接与卤代烃反应来鉴别卤代烃。因为卤代烃中的卤素均是以卤原子的形式与碳原子结合,不能在水溶液中直接电离出X-(F-、Cl-、Br-、I-),故不能与Ag+反应产生沉淀。

练习册系列答案
相关题目
 。
。