题目内容
(6分)等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为___ ___,B的平均反应速率为____ __,x的值是__ ____。
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为___ ___,B的平均反应速率为____ __,x的值是__ ____。
 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为___ ___,B的平均反应速率为____ __,x的值是__ ____。
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为___ ___,B的平均反应速率为____ __,x的值是__ ____。0.75 0.05 2
略

练习册系列答案
相关题目
 5 kJ/mol
5 kJ/mol  。(填序号)
。(填序号) C(g)+ 2D(g),2分钟末反应达到平衡状态,D的浓度为0.4 mol·L-1,求
C(g)+ 2D(g),2分钟末反应达到平衡状态,D的浓度为0.4 mol·L-1,求 H2+CO2若起始浓度[CO]为2mol/L、[H2O]=
H2+CO2若起始浓度[CO]为2mol/L、[H2O]= 3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题: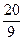 时,b=
时,b= 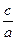 =
=  2SO3(g)(放热反应),下列判断正确的是
2SO3(g)(放热反应),下列判断正确的是 Z(g)+2W(g)。达平衡时,A的体积为1.2aL。下列说法正确的是
Z(g)+2W(g)。达平衡时,A的体积为1.2aL。下列说法正确的是
 2SO3(g)。下列哪种量不再变化时,不能说明化学反应已经达到平衡状态的是
2SO3(g)。下列哪种量不再变化时,不能说明化学反应已经达到平衡状态的是