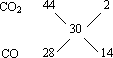题目内容
通常情况下,CO与O2的混合气体m L,用电火花引燃后体积变为n L(在相同条件下测定).
(1)试确定原混合气体中CO与O2的体积.
(2)若反应后的气体密度在相同条件下为氢气的15倍时,试确定反应气体的组成及体积之比.
解析:
|
答案:(1)(A)当两者恰好完全作用时,V(CO)=2(m-n)L V(O2)=(m-n)L; (B)当CO过量时,过量的CO的体积=m L-[2(m-n)L+(m-n)L]=(3n-2m)L,原混合物中V(O2)=(m-n)L V(CO)=(3n-2m)L+2(m-n)L=n L; (C)当O2过量时,过量的O2的体积=m L-[2(m-n)L+(m-n)L]=(3n-2m)L;原混合物中V(CO)=2(m-n)L,V(O2)=(3n-2m)L+(m-n)L=(2n-m)L; (2)CO2与CO的体积比为1∶7. 思路解析:由反应: 2CO + O2 2 1 2 1 2(m-n) (m-n) (m-n) 可知:(A)当两者恰好完全作用时,V(CO)=2(m-n)L V(O2)=(m-n)L (B)当CO过量时,过量的CO的体积=m-[2(m-n)+(m-n)]=(3n-2m)L 原混合物中V(O2)=(m-n)L V(CO)=(3n-2m)L+2(m-n)L=nL (C)当O2过量时,过量的O2的体积=m L-[2(m-n)L+(m-n)L]=(3n-2m)L 原混合物中V(CO)=2(m-n)L V(O2)=(3n-2m)L+(m-n)L=(2n-m)L 若反应后的气体密度在相同条件下为氢气的15倍时,混合气体的平均相对分子质量是30,由于产物中肯定有CO2,它的相对分子质量大于30,所以另一种气体的相对分子质量必小于30,另一种气体只能是CO(也就是说O2不可能有余),该混合气体的组成可用下法求得: 可得V(CO2)∶V(CO)=1∶7 |