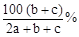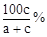题目内容
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
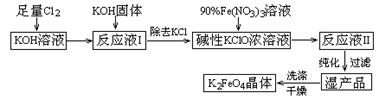
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。

已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
(1)温度较低(2)2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
(3)+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。
(4)FeO42-+3e-+4H2O= Fe(OH)3+5OH-;2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-
(5)与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物
(6)KNO3 KCl
 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑(3)+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。
(4)FeO42-+3e-+4H2O= Fe(OH)3+5OH-;2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-
(5)与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物
(6)KNO3 KCl
试题分析:(1)根据反应方程式可知:该生产工艺应在温度较低的情况下进行;(2)在工业上一般用电解法制取氯气。制取Cl2的化学方程式为2NaCl + 2H2O
 2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3和KCl。
2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3和KCl。
练习册系列答案
相关题目

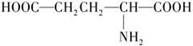 )的熔点高达205℃,难溶于苯等有机溶剂,主要是因为形成内盐
)的熔点高达205℃,难溶于苯等有机溶剂,主要是因为形成内盐