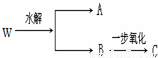
题目内容
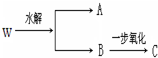
(1)若A、C都能发生银镜反应,则A的结构简式为
(2)若A能发生银镜反应、C不能,则W可能的结构简式有
(3)若A、C均不能发生银镜反应,则W可能的结构简式有
(4)若A、B相对分子质量相等,符合条件的W的结构简式有为
(5)能满足上图中转化关系的W共有
(1)若A、C都能发生银镜反应,则A为HCOOH,C为醛,为C3H7-CHO,根据-C3H7的异构体判断W的异构体数目;
(2)若A能发生银镜反应、C不能,则A为HCOOH,C为酮,则B为CH3CH(OH)CH2CH3;
(3)若A、C均不能发生银镜反应,则A不是甲酸,C为酮,C至少含有3个碳原子,则A为乙酸、B为2-丙醇;
(4)若A、B相对分子质量相等,则B比A多一个碳原子,形成酯的羧酸与醇的碳原子总数为5,据此计算羧酸与醇含有的碳原子,进行书写判断;
(5)分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为6,讨论羧酸与醇含有的碳原子,且醇能发生催化氧化,据此进行书写判断.
(1)若A、C都能发生银镜反应,则A为HCOOH,C为醛,为C3H7-CHO,-C3H7的异构体有:正丙基、异丙基2种,故符合条件的B由2种,则W有2种结构,
故答案为:HCOOH;2;
(2)若A能发生银镜反应、C不能,则A为HCOOH,C为酮,则B为CH3CH(OH)CH2CH3,故W为HCOOCH(CH3)CH2CH3,只有1种结构,
故答案为:1;
(3)若A、C均不能发生银镜反应,则A不是甲酸,C为酮,C至少含有3个碳原子,则A为乙酸、B为2-丙醇,则W为CH3COOCH(CH3)2,只有1种结构,
故答案为:1;
(4)若A、B相对分子质量相等,则B比A多一个碳原子,形成酯的羧酸与醇的碳原子总数为5,则A中碳原子数目为2,A为CH3COOH,B中碳原子数目为3,丙烷中有2种氢原子,故丙醇有2种同分异构体,故W的结构有2种,
故答案为:2;
(5)若为甲酸和丁醇酯化,丁醇有4种:HOCH2CH2CH2CH3、HOCH2CH(CH3)2、HOCH(CH3)CH2CH3、HOC(CH3)3,其中HOC(CH3)3不能发生催化氧化,符合条件的醇有3种;
若为乙酸和丙醇酯化,丙醇有2种:HOCH2CH2CH3、HOCH(CH3)2;
若为丙酸和乙醇酯化,丙酸有1种,乙醇只有1种;
若为丁酸和甲醇酯化,甲醇只有1种,丁酸有2种:CH3CH2CH2COOH、(CH3)2CHCOOH,
故符合条件的W共有3+2+1+2=8,
故答案为:8.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)
4R(s)+2Z3(g)
则16g Z2(g)完全转化为Z3(g)的△H= .
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
|
元素 |
相关信息 |
|
T |
T原子所处的周期数、族序数分别与其原子序数相等 |
|
X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
|
Z |
Z的基态原子价电子排布为 |
|
Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
|
R |
3p能级上有1个电子 |
|
W |
W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为
(填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .